
| A、四氯化碳与溴的混合物 |
| B、植物油和水 |
| C、双氧水和水的混合物 |
| D、酒精和水的混合物 |
科目:高中化学 来源: 题型:
| A、该混盐水溶液呈碱性 |
| B、该混盐溶液加入BaCl2可以生成白色沉淀 |
| C、该混盐与H2SO4反应有气体生成 |
| D、该混盐在酸性条件下可生成S,每产生1molS转移1.5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在地壳中,B元素的含量位于第二位 |
| B、A、B、D三种元素形成的化合物一定是强酸 |
| C、A元素与C元素形成的化合物与水反应后,溶液呈碱性 |
| D、B元素与C元素形成的化合物C2B和C2B2中阴、阳离子个数比不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3中胶粒直径小于1nm |
| B、可以发生丁达尔现象 |
| C、Fe(OH)3能通过滤纸 |
| D、Fe(OH)3胶粒带正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、2NA个HCl分子与44.8L H2和Cl2的混合气体所含的原子数目有可能不相等 |
| C、标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| D、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1 NA到0.2 NA之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
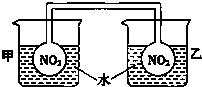 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是
(1)某短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连.下列有关说法中错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )| A、在(t1+1)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| B、在(t1+1)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、不再增减物质,只改变压强或温度时,A的体积分数V(A)%变化范围为25%<V(A)%<40% |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com