


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
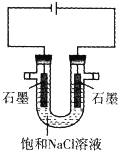
| A、滴加适量盐酸,可以使电解质溶液复原 |
| B、在U形管两端分别滴加酚酞试液,右端变红 |
| C、可用中和滴定的方法测定生成的氢氧化钠溶液的物质的量浓度 |
| D、若得到22.4 LH2(标准状况下),理论上需要转移NA个电子(NA为阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用简易量热计能粗略测量稀盐酸和烧碱稀溶液中和反应的反应热 |
| B、pH<7的溶液不可能呈中性 |
| C、所有化学反应的反应热均可通过实验直接测定 |
| D、铅酸蓄电池充电和放电时的所发生的反应互为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
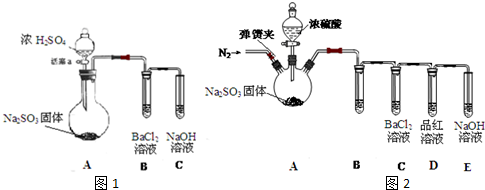
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸 |
| Ⅰ |
| 蒸馏 |
| Ⅱ |
| 水 |
| Ⅲ |
| Zn |
| Ⅳ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com