
����Ŀ��ǰ������Ԫ��A��B��C��D��Eԭ����������������֪��A��Cͬ���壬A��ԭ�������������Ǵ�����3����B���������������ǿ�ᣬ��������ǿ�D��ԭ�Ӱ뾶�ǵ�3��������С�ģ�E���γɹ��������ݵ���ҪԪ�أ���E�����ܺ�ˮ��Ӧ�������з����������
A.A�� B�γɵĻ��������Ϊ�ͻ����
B.A��C���⻯��ķе㣺C>A
C.�����Ӱ뾶��E<D<C
D.E��D�γɵĻ�����ĵ���ʽ��![]()
���𰸡�B
��������
ǰ������Ԫ��A��B��C��D��Eԭ����������������֪��A��Cͬ���壬A��ԭ�������������Ǵ�����3����A��O����C��S��B���������������ǿ�ᣬ��������ǿ�B��Al��D��ԭ�Ӱ뾶�ǵ�����������С�ģ�D��Cl��E���γɹ��������ݵ���ҪԪ�أ���E�����ܺ�ˮ��Ӧ��E��Ca���ݴ˽��
�������Ϸ�����֪A��B��C��D��E�ֱ���O��Al��S��Cl��Ca��
A. A��B�γɵĻ���������������Ϊ�ͻ���ϣ�A��ȷ��
B. ˮ���Ӽ�����������A��C���⻯��ķе㣺C��A��B����
C. ��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С��������Ӱ뾶��E��D��C��C��ȷ��
D. E��D�γɵĻ����������ӻ������Ȼ��ƣ�����ʽΪ![]() ��D��ȷ��
��D��ȷ��
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��)�ǰ��Ƶ��в�ҩ��ҩЧ�ɷ֣�Ҳ���ö��AΪԭ���Ʊ����ϳ�·��������

�ش�����������
��1�����ķ�Ӧ����Ϊ_____________________��B�����������_________��ԭ�ӹ�ƽ�档
��2��C�к��������ŵ�����Ϊ______________________�����ġ�����a��Ϊ____________________��
��3����Ϊ�ӳɷ�Ӧ����ѧ����ʽΪ__________________________________��
��4�����Ļ�ѧ����ʽΪ__________________________________��
��5�����㻯����J��D��ͬ���칹������������������J�Ľṹ����_________�������к˴Ź�������Ϊ������J�Ľṹ��ʽΪ_________________��(ֻдһ�ּ���)��
��������ֻ��3��ȡ������������NaHCO3��Ӧ�ų�CO2����1mol J���к�3mol NaOH��
��6��������ͼ��Ϣ��д���� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·��(���Լ���ѡ) ��______________
�ĺϳ�·��(���Լ���ѡ) ��______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������Ϊ10L���ܱ������У�3molX��1molY���з�Ӧ��2X(g)+Y(g)![]() Z(g)����2min�ﵽƽ�⣬����0.6mol Z������˵����ȷ����( )
Z(g)����2min�ﵽƽ�⣬����0.6mol Z������˵����ȷ����( )
A.��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.01 mol/(L��s)
B.�����������Ϊ20L��Z��ƽ��Ũ��Ϊԭ����![]()
C.������ѹǿ��������Y��ת���ʼ�С
D.�������¶ȣ�X���������������÷�Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��M��NΪ������Ԫ����ԭ��������������X��M��W��N�ֱ�ͬ���壬��Ԫ��X��Y��Z��W�������������ڣ���������ԭ������֮��Ϊ22������������֮��Ϊ16���ڻ�����Y2X6��Z2X4��X2W2�У���Ӧ�����ڸ�ԭ���������Ӷ������ȶ��ṹ����ش��������⣺
(1)YԪ�������ڱ��е�λ����____________��X��Y��Z��W��M��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��__________________________(��Ԫ�ط��ű�ʾ)��
(2)д��Y2X6�ĵ���ʽ_____��Z2X4�ṹʽ______��X2W2������ѧ��������______��
(3)�õ���ʽ����M2N���γɻ�������γɹ���_________________________��
(4)����X��W��M��N����Ԫ�ص����ֻ��������Ӧ�д̼�����ζ����ų�����Ӧ�����ӷ���ʽΪ__________________��
(5)�����������������Z2X4��ȼ��X2W2����ȼ�������ﻷ������Ⱦ��д�����߷�Ӧ�ķ���ʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������Ҵ���Ũ������������ȡ����������װ����ͼ������˵����ȷ����
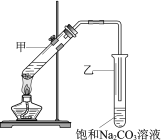
A. ����Թ����ȼ�Ũ���ᣬ�ټ��Ҵ�������
B. ���Թ��е��ܲ�����Һ���£���Ϊ�˷�ֹ����
C. ����������ᣬ��ʹ�Ҵ���ȫת��Ϊ��������
D. ʵ����ϣ��ɽ����������ӻ�����й��˳���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵ����Ԫ����(Ce)�����У�3����4���ּ�̬����ĺϽ����£������������������ƽ����������Ԫ������Ȼ������Ҫ�Է�̼�����ʽ���ڣ�����Ҫ��ѧ�ɷ�ΪCeFCO3����ҵ�����÷�̼�����ȡCeCl3��һ�ֹ����������£�

(1)Ϊ����߱���Ч�ʿ��Բ�ȡ�Ĵ�ʩ��______________��(�ش���������)
(2)������������Ӧ��CeO2��CeF4�����ʵ���֮��Ϊ3��1����д����Ӧ�Ļ�ѧ����ʽ�� ______����ͬѧ��Ϊ�����������ϡ�����H2O2�滻������ã��������ǣ�___________��
(3)�����£�����Һ�е�ij����Ũ�ȡ�1.0��10��5 mol��L��1ʱ������Ϊ�����ӳ�����ȫ���ݴˣ�������Ce(OH)3�ķ�Ӧ�У�����NaOH��Һ��pH���ٴﵽ________ʱ��������ΪCe3������ȫ������{Ksp[Ce(OH)3]��1.0��10��20}��
(4)��Ce(BF4)3�м���KCl��Һ���÷�Ӧ�ܷ�����ԭ����____________________��
(5)�����к��е���Ⱦ��NO���Ա���Ce4������Һ���գ�����NO2-��NO3-���õ��ķ����ɽ���������Һ�е�NO2-ת��Ϊ�ȶ��������壬ͬʱ��Ce3������ΪCe4������ԭ����ͼ��ʾ��

��NO2-�ӵ��۵�________(����ĸ���)�ڽ��롣
��ÿ���ɱ�״����11.2 L�����壬ͬʱ������Ce4��________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ľ����ṹΪ��������(��ͼ��ʾ)�����־�����A��B��C��������Ŀ֮��Ϊ(����)

A. 1��4��2 B. 3��9��4
C. 2��9��4 D. 3��8��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϡ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų�����ͼ��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� ��BԪ��λ�����ڱ���������е� ����
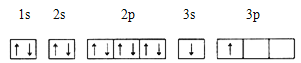
��ACl2������A���ӻ�����Ϊ ��ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����CN-��Ϊ�ȵ�����ĵ��ʵĵ���ʽ ��
���������������[Fe(CN)6]4-����� ��
A�����ۼ�
B���Ǽ��Լ�
C�����
D������
E������
��3��һ��Al��Fe�Ͻ�����徧������ͼ��ʾ����ݴ˻ش��������⣺
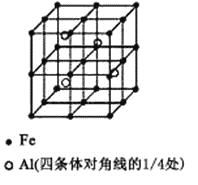
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶȣ��� g/cm3����˺Ͻ������������Feԭ��֮��ľ���(�ú����Ĵ���ʽ��ʾ�����ػ���)Ϊ cm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com