【答案】
分析:A的单质是密度最小的物质,故A是氢元素;
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;
C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;
D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;
F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素;
(1)活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(2)电子层数越多的离子,其半径越大;电子层结构相同的离子,离子半径随着原子序数的增大而减小;
(3)均含A、B、C、F四种元素的化合物是硫酸氢钠和亚硫酸氢钠,硫酸氢钠呈强酸性能和亚硫酸氢钠反应;
(4)铁和铝的混合物加入足量稀硫酸后生成硫酸亚铁和硫酸铝,向硫酸亚铁和硫酸铝溶液中加入过量氢氧化钠溶液后生成氢氧化亚铁沉淀和偏铝酸钠溶液,沉淀经洗涤、干燥、灼烧后得到一种固体是氧化铁,氧化铁的质量和铁与铝的混合物质量相等,所以铝的质量相当于氧元素的质量,根据质量分数计算即可;
(5)根据得失电子相等写出相应的化学反应方程式,根据反应方程式计算氢氧化钙的质量;
(6)氢化钠与乙醇反应生成乙醇钠和氢气.
解答:解:(1)次氯酸钠中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中氯原子和氧原子之间存在共价键,
故答案为:离子键、共价键(极性共价键);
(2)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离子半径大于氯离子半径,
故答案为:S
2->Cl
->Al
3+;
(3)硫酸氢钠溶液呈强酸性,亚硫酸氢钠是弱酸酸式盐,所以硫酸氢钠和亚硫酸氢钠反应产生硫酸钠、水和二氧化硫,
故答案为:H
++HSO
-3=SO
2↑+H
2O;
(4)铁和铝的混合物加入足量稀硫酸后生成硫酸亚铁和硫酸铝,向硫酸亚铁和硫酸铝溶液中加入过量氢氧化钠溶液后生成氢氧化亚铁沉淀和偏铝酸钠溶液,沉淀经洗涤、干燥、灼烧后得到一种固体是氧化铁,氧化铁的质量和铁与铝的混合物质量相等,所以铝的质量相当于氧元素的质量,所以铝的质量分数=
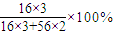
=30%,
故答案为:30%;
(5)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl
2+10Ca(OH)
2=7CaCl
2+2Ca(ClO)
2+Ca(ClO
3)
2+10H
2O;
设需要氢氧化钙的质量为x.
10Cl
2+10Ca(OH)
2=7CaCl
2+2Ca(ClO)
2+Ca(ClO
3)
2+10H
2O
740g 2mol
x 0.1mol
x=37g
故答案为:37g;10Cl
2+10Ca(OH)
2=7CaCl
2+2Ca(ClO)
2+Ca(ClO
3)
2+10H
2O;
(6)氢化钠与乙醇反应生成乙醇钠和氢气,故答案为:NaH+CH
3CH
2OH=CH
3CH
2ONa+H
2↑.
点评:本题考查了元素的推断、离子半径的半径、化学键的判断等知识点,易错的(4)题,明确氧化铁中的氧元素相当于铝元素是解本题的关键.


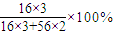 =30%,
=30%,












