
 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.| 1 |
| 2 |
| CuO/CuCl2 |
| 400℃ |

| 870.3kJ |
| 60g |
| 393.5kJ |
| 12g |
| 285.8kJ |
| 2g |


科目:高中化学 来源: 题型:
A、CH3COOH+CH3CH2OH
| |||
B、CH4+Cl2
| |||
C、2CH3CH2OH+O2
| |||
D、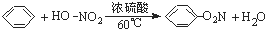 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电 |
| B、燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源 |
| C、普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了 |
| D、由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3是电解质 |
| B、该合成氨过程不属于氮的固定 |
| C、空气、水、太阳能均为可再生资源 |
| D、断裂N2中的N≡N键会释放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
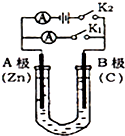 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
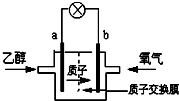 美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )
美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )| A、a极为电池的负极 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应为:4H++O2+4e-=2H2O |
| D、1mol乙醇被氧化,电路中转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| C、植物油和裂化汽油都可以使溴水褪色 |
| D、使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离地面高度(m) | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
| 铅的浓度(ug/m3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
| 化学处理 |
| K2CrO4 |
| 过滤 |
| 洗涤 |
| a |
| 称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 结论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将燃着的镁条伸入盛有CO2的集气瓶中继续燃烧 | 还原性:Mg>C |
| C | SO2可以使酸性KMnO4溶液退色 | 结论:SO2具有漂白性 |
| D | 将铁粉放入稀HNO3中充分反应后,滴入KSCN溶液无明显现象 | 稀HNO3不能将Fe氧化成Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com