
| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
分析 A.物质的量不能表示宏观物质;
B.摩尔是物质的量的单位,不是物理量;
C.1mol任何物质都含有约6.02×1023个微粒;
D.0.012kg12C中所含的碳原子数为阿伏伽德罗常数数值.
解答 解:A.物质的量不能表示宏观物质,米粒是宏观物质,故A错误;
B.摩尔是物质的量的单位,不是物理量,物质的量是国际单位制中的七个基本物理量之一,故B错误;
C.1mol任何物质都含有约6.02×1023个微粒,如1molH2O中含有3mol原子,故C错误;
D.0.012kg12C中所含的碳原子数为阿伏伽德罗常数数值,其近似值为6.02×1023,故D正确;
故选D.
点评 本题考查了有关物质的量、摩尔质量、阿伏伽德罗常数等几个概念,侧重于基础知识的考查,题目难度不大,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 工业合成氨时采用铁触媒作反应的催化剂 | |
| C. | 工业生产硫酸的过程中使用过量的空气以提高SO2的转化率 | |
| D. | 将收集NO2气体的烧瓶密闭后放在装有热水的烧杯中,发生颜色变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8L0.1mol•L-1的KCl溶液 | B. | 0.2L0.2mol•L-1的HCl溶液 | ||
| C. | 0.3L0.2mol•L-1的MgCl2溶液 | D. | 0.5L 0.1mol•L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2O2与 H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 碳酸镁与稀盐酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢原子的结构示意图为: ;则反氢原子的结构示意图为: ;则反氢原子的结构示意图为: | |
| B. | 反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子 | |
| C. | 反氢原子的摩尔质量为1g/mol | |
| D. | 21H的反氢原子中有2个带负电荷的反质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
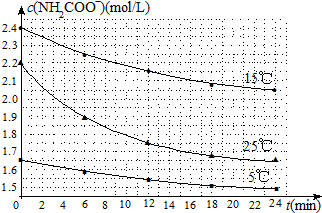
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com