
| A. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O-4e-=O2↑+4H+ | |
| B. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| C. | H3PO2溶于水的电离方程式为H3PO2?H++H3PO2- | |
| D. | H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-=PO23-+3H2O |
分析 A.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子;
B.H3PO2具有还原性,能被酸性重铬酸钾氧化;
C.一元弱酸在溶液中部分电离出一个氢离子;
D.一元弱酸与NaOH按照物质的量1:1反应.
解答 解:A.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子,所以用惰性电极电解NaH2PO2溶液,其阳极反应式为H2PO2--4e-+2H2O═H3PO4+3H+,故A错误;
B.H3PO2具有还原性,能被酸性重铬酸钾氧化,则将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的氧化产物为H3PO4,故B错误;
C.一元弱酸在溶液中部分电离出一个氢离子,则H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2-,故C正确;
D.一元弱酸与NaOH按照物质的量1:1反应,所以H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O,故D错误;
故选C.
点评 本题考查氧化还原反应、电离方程式的书写、电解原理的应用等知识点,明确物质的性质是解本题关键,利用电极方程式的书写方法、电离方程式书写规则、盐类水解原理解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 烧瓶中要放入碎瓷片防止暴沸 | |
| B. | 不用温度计 | |
| C. | 冷凝水应该是下进上出,与蒸汽的流向相反 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
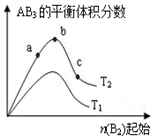 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
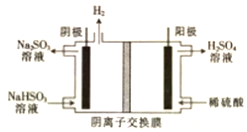 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中,有化学键的断裂与形成 | |
| B. | MgCl2晶体中存在离子键与共价键 | |
| C. | NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | CO2和SiO2晶体都是由分子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
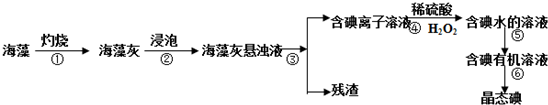
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com