
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
| 总质量 |
| 体积 |


科目:高中化学 来源: 题型:
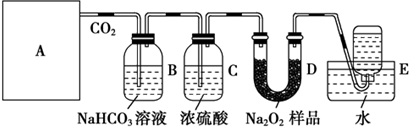

查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同. | 温度 (℃) | 乙醇转化率 (%) | 有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
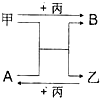 甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:
甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
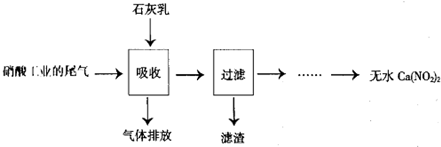
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
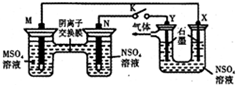 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、福尔马林可作食品的保鲜剂 |
| B、氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 |
| C、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| D、浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com