
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
分析 溶液中Al3+离子物质的量为0.3mol,SO42-为0.4mol,加入一定量的Ba(OH)2溶液,测得溶液与沉淀中均含有铝元素,则溶液中Al元素为Al3+或AlO2-,结合3OH-+Al3+=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O计算加入Ba(OH)2的物质的量范围,再结合Ba2++SO42-=BaSO4计算.
解答 解:溶液中Al3+离子物质的量为0.3mol,SO42-为0.4mol,加入一定量的Ba(OH)2溶液,测得溶液与沉淀中均含有铝元素,则溶液中Al元素为Al3+或AlO2-,
溶液中Al元素为Al3+形式存在时,
3OH-+Al3+=Al(OH)3↓
0.9mol 0.3mol 0.3mol
则加入Ba(OH)2物质的量:0<n(Ba(OH)2)<$\frac{0.9mol}{2}$=0.45mol,结合Ba2++SO42-=BaSO4可知,n(BaSO4)<0.4mol;
溶液中Al元素为AlO2-形式存在时,
3OH-+Al3+=Al(OH)3↓
0.9mol 0.3mol 0.3mol
Al(OH)3+OH-=AlO2-+2H2O
0.3mol 0.3mol
则则加入Ba(OH)2物质的量:$\frac{0.9mol}{2}$=0.45mol<n(Ba(OH)2)<$\frac{0.9mol+0.3mol}{2}$=0.6mol,结合Ba2++SO42-=BaSO4可知,n(BaSO4)<0.4mol,
故生成BaSO4的物质的量不可能为0.45mol,
故选:D.
点评 本题考查离子反应有关计算,关键是判断溶液中铝元素存在学生,若为单项选择,可以根据硫酸根守恒进行判断,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △Hl<△H2<△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| B. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 | |
| C. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
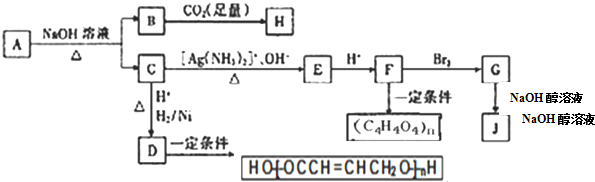
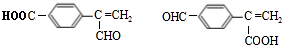 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化碳中含有氧原子数为0.3 NA | |
| C. | 常温下,2.7 g铝与足量的盐酸反应,失去的电子数0.3 NA | |
| D. | 常温下,0.1 mol/L MgCl2溶液中含Cl-数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlN是氧化产物,其中N是+3价 | B. | 氧化剂是N2,还原剂是C | ||
| C. | Al2O3既不是氧化剂,也不是还原剂 | D. | 每生成2mol AlN,有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com