
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| ||
| A、K+不一定存在 |
| B、K+、NH4+、CO32-、SO42- 一定存在 |
| C、Cl-一定存在 |
| D、Cl-、Mg2+、Ba2+一定不存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、φ1>φ2 |
| B、n1>n2 |
| C、n1=n2 |
| D、φ1<φ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
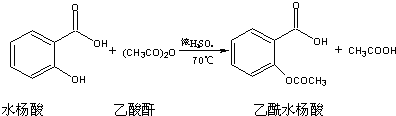

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 产品中不含Na2SO4 | ||
| ③ | 向试管C中, | 产品中不含水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )
广泛存在于食物中,它可能具有抗癌性,能与1mol该化合物起反应的Br2或H2的最大用量分别为( )| A、1mol,7mol |
| B、3.5mol,7mol |
| C、3mol,6mol |
| D、6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
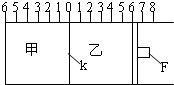 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.5 | 2.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com