
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
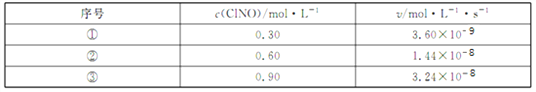
n =____________;k =__________________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
【答案】 K12/K2( 289-2a 2 4.0×10-8L/(mo1·s) < 0.1 2L/mol A D
【解析】(1)已知:①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
将①×2-②可得:2NO(g)+Cl2(g)![]() 2ClNO(g),因此平衡常数K3=K12/K2;
2ClNO(g),因此平衡常数K3=K12/K2;
(2)2NO(g)+C12(g)![]() 2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
(3)根据数据,结合正反应速率表达式为v正=k·cn(ClNO)可知,3.60×10-9mo1/(L·s)=k×(0.3mo1/L)n,1.44×10-8mo1/(L·s)=k×(0.6mo1/L)n,解得n=2,k=4.0×10-8L/(mo1·s);
(4)①根据图像,T2>T1,降低温度c(ClNO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;②反应开始到10min时,c(ClNO)=1mol/L,则v(ClNO)=![]() =0.1mol/(L·min),则NO的平均反应速率v(NO)=v(ClNO)=0.1mol/(L·min);③根据方程式可知
=0.1mol/(L·min),则NO的平均反应速率v(NO)=v(ClNO)=0.1mol/(L·min);③根据方程式可知
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始(mol/L) 2 1 0
反应 1 0.5 1
平衡 1 0.5 1
T2时该反应的平衡常数K=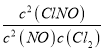 =
=![]() =2;
=2;
(5)n(NO)/n(Cl2)的比值越小,NO的转化率越大,NO的转化率最大的是A点,根据曲线的变化趋势,当n(NO)/n(Cl2)=1.5,达到平衡状态ClNO的体积分数是D。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。
【查阅资料】① NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;③2NaNO3![]() 2NaNO2 + O2↑,NaNO2热稳定性很高。
2NaNO2 + O2↑,NaNO2热稳定性很高。
【实验探究1】 兴趣小组的同学经讨论设计了如下图所示实验:

(l)仪器a的名称是_______;干燥管D的作用是_______;
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是_______;
(3)若无B装置,后果是_______;
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是_______;
【实验探究II】 该兴趣小组进一步探究一中生成的白色固体的成分。
(5)提出假设:假设1.白色固体只有NaNO2;假设2.白色固体只有_____;假设3.白色固体是NaNO2和NaNO3 两种物质的混合物。
(6)实验验证:
① 要证明假设2是否成立,实验操作、现象和结论是______________。
② 为证明是假设l还是假设3成立,称取C中生成的白色固体ag置于坩埚中(坩埚质量为cg),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为bg,假设3成立时b~c的数字范围是__________。(用含a的不等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】姜黄素是从姜科植物中提取的一种色素,它的主要药理作用有抗氧化、保肝护肝、抑制肿瘤生长等,它具有对称性结构。

己知:E、G能发生银镜反应![]() (R、R、R"表示烃基或氢原子)
(R、R、R"表示烃基或氢原子)
请根据以上信息回答下列问题:
(1)生成A的反应类型是______,试剂X的名称是_________。
(2)写出下列反应的化学方程式
A→B:_____________;E→F:_____________。
(3)G的核磁共振氢谱峰面积之比________。
(4)J(C8H8O3)的同分异构体中同时满足如下条件:① 能与NaHCO3反应,② 能使FeCl3溶液显色,共有______种(不考虑立体异构),其中苯环上的一氯代物有两种的同分异构体的结构简式是_______。
(5)姜黄素的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不正确的是( )
A. 酸性强弱:HI>HBr>HCl
B. 非金属性:O>S>Se
C. 还原性强弱:F->Cl->I-
D. 碱性强弱:KOH>NaOH>LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为
A.(y-2x)/a B.(y-x)/a C.(2y-4x)/a D.(2y-2x)/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,其中元素X的原子最外层电子数为其 周期数的两倍,元素Y和W分别形成的A2B型氢化物均为V形分子,元素Z的原子半径是短周期元素中最大的。下列说法中正确的是( )
A. 元素Z、W的简单离子半径:Z>W
B. 元素X与氢元素形成的原子个数之比为1:1的化合物有很多种
C. 由这些元素形成的三原子分子中,空间结构为直线形的有XY2、XW2、WY2
D. 元素Y与Z可形成含有非极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯可用于合成纤维、橡胶、塑料等。回答下列问题:
(1)用CPO3作催化剂,CO2重整C2H6制乙烯的反应如下:
C2H6(g)=C2H4(g)+H2(g) △H1
H2(g)+CO2(g)=H2O(g)+CO(g) △H2
反应C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
(2)向一体积为2 L的恒容密闭容器中充入0.1 mol C2H6和0.1 mol CO2发生反应: C2H6(g ) +CO2 (g )=C2H4 (g) +CO(g) + H2O(g ),C2 H6的平衡转化率与温度的关系如图所示。

①该反应的正反应为________(填“放热”或“吸热”)反应。
②在相应温度下,A点反应速率(正 )_________(填“>”“<"或“=”)![]() 。
。
③B点在相应温度下的平衡常数K= ______ 。
④容器中反应达到平衡后,若要增大C2H6的转化率,除升高温度外,还可采取的措施有__________(任答一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com