
设NA为阿伏加德罗常数的值,N表示粒子数。下列说法正确的是
A.0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA
B.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)]
C.一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA
D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(8分)下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族 周期 | ⅠA | 0 | |||||||
1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ⑤ | Ne | |||||||
3 | ① | ② | ③ | ④ | ⑥ |
(1)元素④的符号是 ;
(2)⑤和⑥两种元素原子半径的大小关系:⑤ ⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:① ②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: _ ________ _______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:简答题
(16分)查尔酮类化合物是黄酮类药物的主要合成中间体。
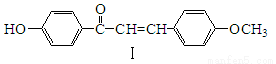
(1)下列查尔酮类化合物I的说法正确的是 。
A.加入溴的四氯化碳溶液,溶液褪色
B.可发生加成或取代反应
C.不与NaOH溶液发生反应
D.加入新制的氢氧化铜有红色沉淀生成
(2)反应①是制取查尔酮类化合物的一种方法:

化合物III的分子式是 ,1mol化合物III最多能与 mol H2发生加成反应。
(3)化合物II可由化合物IV(分子式:C8H10O)在Cu催化氧化下制得,则化合物IV的结构简式为 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1∶1∶2∶6,则V的结构简式为 (任写一种)。
(4)聚合物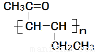 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol苯中含有3nA个碳碳双键
B.标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA
C.1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子
D.1L 0.1 mol·L-1 Na2S溶液中含有0.1nA个S2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:填空题
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0. 1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中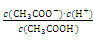 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:简答题
(16分)工业上硫酸锰铵[(NH4)2Mn(SO4)2]可用于木材防火涂料等。其制备工艺如下: 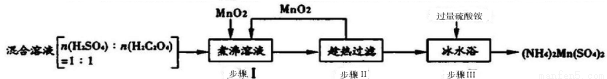
已知步骤Ⅰ反应:H2C2O4(aq) +H2SO4(aq) +MnO2(s) MnSO4(aq)+2CO2(g)+2H2O(1) △H
MnSO4(aq)+2CO2(g)+2H2O(1) △H
(1)在步骤I的反应中,氧化剂是 。
(2)步骤Ⅱ中趁热过滤前需向MnSO4溶液中加入少量热水,其目的是____;步骤III所得(NH4)2Mn(SO4)2:晶体需用酒精溶液洗涤,洗去的主要杂质离子有____ 。
(3)下列操作有利于提高产品产率的是____(填序号)。
A.慢慢分次加入二氧化锰 B.趁热过滤
C.冰水浴充分冷却 D.用水代替酒精溶液洗涤
(4)一定条件下,在步骤I的水溶液中l mol MnO2完全反应相相对能量变化如图。则△H=____;催化剂是否参加化学反应? (填“是”或“否”或“不确定”)。

(5)碱性干电池中含大量MnO2可以回收利用,该电池工作时的正极反应式为____ ;若从干电池中回收87 kg MnO2,理论上可以获得(NH4)2Mn( S04)2 _kg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
如图为元素周期表的一部分,W、X、Y、Z均为短周期主族元素。下列分析—定正确的是
W | X | |
Y | Z |
A.Y的气态氢化物最稳定
B.Z的单核阴离子还原性最强
C.x单质常温下化学性质活泼
D.Y的原子序数比W大7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如下装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
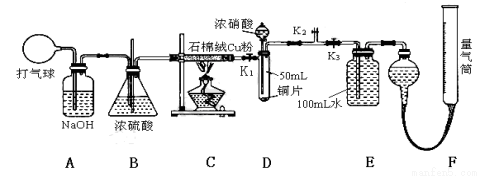
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是 ;
(2)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分
是 (填化学式),通入该气体的目的是 ;进行此步操作时应关闭 ,打开 (填K1、K2或K3)。
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____ __________。
(4)若E装置中出现倒吸,可采取的应急操作是 ;
(5)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol·L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应 (填“有”或“无”)NO生成。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用活性炭去除冰箱中的异味 | 发生了化学变化 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 没有发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com