
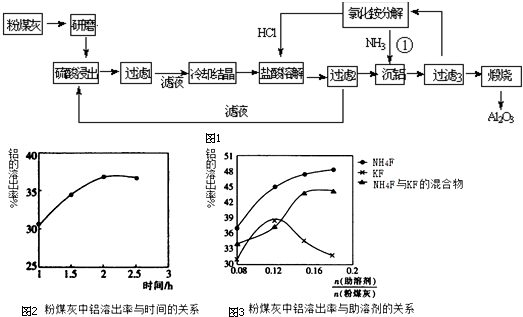
分析 粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等,加入硫酸溶液使Al2O3溶解,CaO通过反应生成CaSO4,CaSO4微溶,大部分CaSO4和SiO2一起成为滤渣,过滤后将滤液冷却结晶得Al2(SO4)3,用盐酸溶解Al2(SO4)3,由滤液可以进行硫酸的循环利用,可知通入氯化氢得AlCl3晶体和硫酸溶液,沉铝后煅烧达到氧化铝,可知AlCl3晶体溶解后得氯化铝溶液,再通入氨气得氢氧化铝沉淀和氯化铵溶液,氯化铵溶液可以循环利用,氢氧化铝沉淀受热分解生成Al2O3.
(1)可以增大接触面积,提高浸取速率;
(2)由分析可知,第一次过滤的沉淀主要为二氧化硅与硫酸钙,第二次过滤的沉淀主要为氢氧化铝;
(3)由图可知,2h时Al溶出率以很高,再延长时间溶出率几乎不变;
由图2可知,在$\frac{n(助溶剂)}{n(粉煤灰)}$相同时,NH4F助溶剂对铝的浸出率最高,容易产生HF与氨气而污染环境;
(4)氨水与氯化铝溶液反应达到氢氧化铝沉淀;
(5)增大氯离子浓度,有利于氯化铝晶体的析出.
解答 解:粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等,加入硫酸溶液使Al2O3溶解,CaO通过反应生成CaSO4,CaSO4微溶,大部分CaSO4和SiO2一起成为滤渣,过滤后将滤液冷却结晶得Al2(SO4)3,用盐酸溶解Al2(SO4)3,由滤液可以进行硫酸的循环利用,可知通入氯化氢得AlCl3晶体和硫酸溶液,沉铝后煅烧达到氧化铝,可知AlCl3晶体溶解后得氯化铝溶液,再通入氨气得氢氧化铝沉淀和氯化铵溶液,氯化铵溶液可以循环利用,氢氧化铝沉淀受热分解生成Al2O3.
(1)粉煤灰研磨的目的是:增大反应物的接触面积,提高浸取速率和浸出率,
故答案为:增大反应物的接触面积,提高浸取速率和浸出率;
(2)通过上面的分析可知,第1次过滤时滤渣的主要成分有SiO2和 CaSO4,第3次过滤时滤渣的成分是Al(OH)3,
故答案为:SiO2、CaSO4;Al(OH)3;
(3)根据图1可知,2h时铝的浸出率达到最大值,再延长时间溶出率几乎不变,所以适宜的浸取时间为2h,
根据图2可知,在$\frac{n(助溶剂)}{n(粉煤灰)}$相同时,NH4F助溶剂对铝的浸出率最高,用含氟的化合物作这种助溶剂的缺点是生产过程中会产生污染环境的HF和NH3等,
故答案为:2; NH4F;生生成过程中产生HF及NH3等污染环境;
(4)流程图中①处发生的离子反应方程式:Al3++3NH3•H2O=Al(OH)3+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3+3NH4+;
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13晶体,该过程能够发生的原因是:通入氯化氢使A1C13达到饱和,而硫酸铝不饱和,便于A1C13晶体析出,
故答案为:通入氯化氢使A1C13达到饱和,而硫酸铝不饱和.
点评 本题考查物质制备工艺流程,关键是对工艺流程的理解,对盐酸溶解与沉铝操作理解是难点,注意根据硫酸循环利用及沉铝后煅烧达到氧化铝理解,是对学生综合能力的考查,难点较大.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: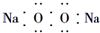 | |
| B. | 碳正离子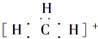 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: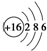 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{H_{2}O+O_{2}}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com