
| A、制备光导纤维 |
| B、制汽轮机叶片 |
| C、制永久性模具 |
| D、制造柴油机 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、鸡蛋白溶液中加入硫酸铵溶液变浑浊 |
| B、用福尔马林溶液浸泡动物标本 |
| C、用波尔多液(含CuSO4等)防治作物病虫害 |
| D、医院用加热法消毒医疗器械 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠是一种银白色金属 |
| B、熔点为97.81℃,密度为0.97 g?cm-3 |
| C、钠与H2O剧烈反应 |
| D、钠在室温下氧化和在空气中燃烧得到不同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
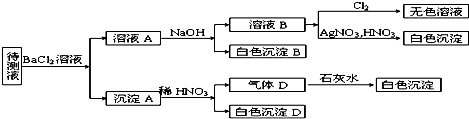
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L H2SO4 |
| B、0.5 mol/L NaOH |
| C、0.5 mol/L AgNO3 |
| D、0.5 mol/L NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| B、配制0.1mol/L的Na2CO3溶液480mL,需要500mL容量瓶 |
| C、在标准状况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 |
| D、在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
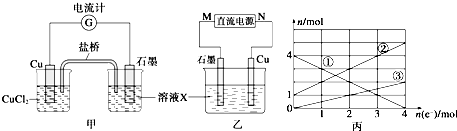
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B、根据同周期元素的非金属性变化趋势,推出O元素的非金属性比N元素弱 |
| C、根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| D、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com