
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
分析 (1)亚铁离子水解,破坏水的电离平衡,使溶液呈酸性;
(2)①硝酸具有强氧化性,将亚铁离子氧化为铁离子,自身被还原生成NO,NO与氧气反应生成二氧化氮;
②铁离子遇KSCN溶液显红色;
③稀硝酸中亚铁离子被氧化为铁离子,使生成[Fe(NO)]2+的平衡逆向移动,最终完全氧化为铁离子;
(3)①往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化,说明硝酸将二氧化硫氧化为硫酸;
②溶液上方产生红棕色的气体,说明硝酸根被还原,溶液没有深棕色出现,说明铁离子没有被还原为亚铁离子;
③溶液变为浅绿色,说明硝酸根反应完毕,铁离子氧化二氧化硫,而被还原为亚铁离子;
④氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.
解答 解:(1)亚铁离子水解:Fe2++2H2O?Fe(OH)2+2H+,破坏水的电离平衡,使溶液呈酸性,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(2)①硝酸具有强氧化性,将亚铁离子氧化为铁离子,自身被还原生成NO,NO与氧气反应生成二氧化氮,
故答案为:NO2;
②检验Fe3+的操作是:取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+,
故答案为:取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+;
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是:在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色,
故答案为:在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色;
(3)①往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化,说明硝酸将二氧化硫氧化为硫酸,反应离子方程式为:2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+,
故答案为:2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+;
②溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+,该同学的说法正确,
故答案为:正确,溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+;
③溶液变为浅绿色,说明硝酸根反应完毕,铁离子氧化二氧化硫,而被还原为亚铁离子,反应离子方程式为:,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
④由发生的氧化还原反应可知,该实验得出的结论是:SO2的还原性比Fe2+的强等,
故答案为:SO2的还原性比Fe2+的强等.
点评 本题考查物质性质探究实验,侧重考查学生对原理分析理解,熟练掌握元素化合物性质,是对学生综合能力的考查,难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向酸性KMnO4溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加 KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大 量共存 |
| D | 向10mL 0.1mol•L-1 Na2S溶液中滴入2mL 0.1mol•L-1 ZnSO4溶液,再加入 2mL 0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: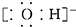 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
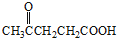 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):
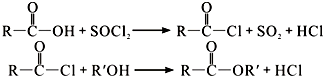
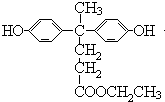
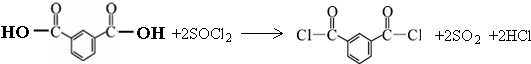 .
. 的路线.
的路线. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com