
�������������ʡ��������Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ��H =" -92.4" kJ/mol
2NH3 (g) ��H =" -92.4" kJ/mol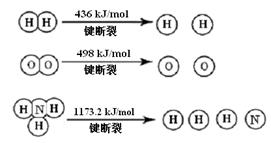
�������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������е� ��ѧ���� ���ǿ������������
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�
N2 (g) + O2 (g) =" 2NO" (g) ��H =" +180.8" kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)��ü�������H2��ת����Ϊ40%��
2NH3 (g)��ü�������H2��ת����Ϊ40%��| | N2 | H2 | NH3 |
| �� | 1 | 3 | 0 |
| �� | 0.5 | 1.5 | 1 |
| �� | 0 | 0 | 4 |
��1��946 kJ/mol ǿ
��2��BC
��3�������� �� ��>��=��
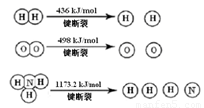
���������������1���ɷ�Ӧ��3H2 (g) + N2 (g)  2NH3 (g) ��H =" -92.4" kJ/mol������Ŀ�е����������Եõ�92.4=2��1173.2-436��3- N��N���ļ��ܣ�����N��N���ļ���Ϊ
2NH3 (g) ��H =" -92.4" kJ/mol������Ŀ�е����������Եõ�92.4=2��1173.2-436��3- N��N���ļ��ܣ�����N��N���ļ���Ϊ
946 kJ/mol�����Զ���1 mol N��N����Ҫ����Ϊ946 kJ�����ܴ��Ӿ�Խ�ȶ������Ե��������л�ѧ�������������еĻ�ѧ����ǿ��
��2��A�����ɱ����Կ����ڳ����£������̵���KΪ3.84��10-31���������̵����������ܽ��У�����ҵ�̵���K�ܴ�ֻ��˵���÷�Ӧ�ij̶Ⱥܴ�����˵���dz������У������̵����¶ȴﵽ2000Kʱ��ƽ�ⳣ����Ȼ��С������������ģģ������̵���������ģ���B��ȷ��CҲ��ȷ����Ϊ�ӱ��п��Կ����¶�Խ�ͣ�ƽ�ⳣ��Խ�����Թ�ҵ�̵��¶�Խ�ͣ�������������ӦԽ��ȫ��KԽ��˵����Ӧ������Խ������˵���ϳɰ���Ӧ������Խ��D�������ΪBC��
��3��3H2 (g) + N2 (g)  2NH3 (g)��ü�������H2��ת����Ϊ40%�����÷�Ӧ��
2NH3 (g)��ü�������H2��ת����Ϊ40%�����÷�Ӧ��
Ũ�ȴ����Ʊ�ΪQ=��0.4��2��2/[��3-0.4��3��3����1-0.4��1��]=0.183��������������
1��1/��0.53��1.5��=5.333> Q�������������з�Ӧ���еķ���Ϊ����
����ȫ��ת��Ϊֻ�������͵�����ʾ����Ϊ
,���ڲ���˵���൱��������ѹǿ��ƽ�������ƶ������Դ�ƽ��ʱ���ס��ҡ�����������NH3�����������С˳��Ϊ��>��=�ҡ� N2 H2 NH3 �� 1 3 0 �� 1 3 0 �� 2 6 0
���㣺��ѧƽ��
���������⿼���˻�ѧƽ�����ؼ��㣬�Ը�֪ʶ��Ŀ���Ƚ����룬������Ϣ���ϴ��ѶȱȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������Уѧ�����˸���12�µ��п������ۻ�ѧ�Ծ��������棩 ���ͣ������
�����Ź㷺����;�������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ������
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ������Ӧ�����ɰ�����

�÷�Ӧ�ڹ̶�������ܱ������н��У��й�˵����ȷ����_____________���������ĸ����
A.��Ӧ����ƽ��״̬ʱ��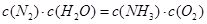
B.��Ӧ�ﵽƽ���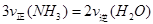
C.��ϵ����ѹǿ���䣬˵����Ӧ�Ѵ�ƽ��
D.���������ܶȱ��ֲ��䣬˵����Ӧ�Ѵ�ƽ��
��2��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ�����������صķ�Ӧ�У�
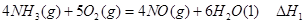 ��
��
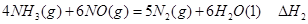 ��
��
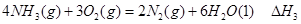 ��
��
��д������������Ӧ��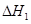 ��
��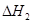 ��
��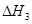 ����֮���ϵ�ı���ʽ��
����֮���ϵ�ı���ʽ��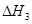 ��_________��
��_________��
��3����ҵ���������Ҫ��Ӧ�ǣ�
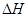 ��
��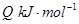
�������¶ȣ���Ӧ��Kֵ��С����Q______���>������<��������0��
������Ӧ��ʼ�����ʵ�����ͬ�����й�ϵͼ�������________������ţ���


�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ�Ũ�����±���
|
ʱ��/Ũ�� |
|
|
|
|
|
��ʼ |
4.0 |
5.5 |
0 |
0 |
|
��2min |
3.2 |
a |
0.8 |
1.2 |
|
��4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
��6min |
2.0 |
3.0 |
2.0 |
3.0 |
��Ӧ�ڵ�2 min����4 minʱ��O2��ƽ����Ӧ����Ϊ________��
��Ӧ�ڵ�2 minʱ�ı����������ı������������______________________________��
�������£���Ӧ��ƽ�ⳣ��K��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�걱���з�̨��������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
�������������ʡ�����ȵ���Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H = -483.6 kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ��H =
-92.4 kJ/mol
2NH3 (g) ��H =
-92.4 kJ/mol
�������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������еĻ�ѧ���� ���ǿ�����������������������߷�Ӧ��������ͬ��
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�N2 (g) + O2 (g) = 2NO (g) ��H = +180.8 kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
|
��Ӧ |
�����̵� |
��ҵ�̵� |
||||
|
�¶�/�� |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84��10-31 |
0.1 |
5��108 |
1.847 |
0.507 |
0.152 |
A�������£������̵����������ܽ��У�����ҵ�̵��dz�������
B��������ģģ������̵����������
C����ҵ�̵��¶�Խ�ͣ�������������ӦԽ��ȫ
D��KԽ��˵���ϳɰ���Ӧ������Խ��
��3���ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ��, ������Ӧ��3H2
(g) + N2 (g)  2NH3
(g)��ü�������H2��ת����Ϊ40%��
2NH3
(g)��ü�������H2��ת����Ϊ40%��
|
|
N2 |
H2 |
NH3 |
|
�� |
1 |
3 |
0 |
|
�� |
0.5 |
1.5 |
1 |
|
�� |
0 |
0 |
4 |
�ж��������з�Ӧ���еķ��� �������������
��ƽ��ʱ���ס��ҡ�����������NH3�����������С˳��Ϊ ��
��4�������Ǻϳ������ԭ�ϣ�д��������������Ӧ����һ����������̬ˮ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�챱���и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
�������������ʡ��������Ҫԭ�ϣ�Χ�ƺϳɰ����ǽ�����һϵ�е��о�
��1�����������뵪������������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ��H =" -92.4"
kJ/mol
2NH3 (g) ��H =" -92.4"
kJ/mol

�������1 mol N��N����Ҫ���� kJ �� ���������л�ѧ�������������е� ��ѧ���� ���ǿ������������
��2���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�
N2 (g) + O2 (g) =" 2NO" (g) ��H =" +180.8" kJ/mol ����ҵ�ϳɰ������˹��̵���
�������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
|
��Ӧ |
�����̵� |
��ҵ�̵� |
||||
|
�¶�/�� |
27 |
2000 |
25 |
350 |
400 |
450 |
|
K |
3.84��10-31 |
0.1 |
5��108 |
1.847 |
0.507 |
0.152 |
A�������£������̵����������ܽ��У�����ҵ�̵��dz�������
B��������ģģ������̵����������
C����ҵ�̵��¶�Խ�ͣ�������������ӦԽ��ȫ
D��KԽ��˵���ϳɰ���Ӧ������Խ��
��3���ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ��, ������Ӧ��
3H2 (g) + N2 (g)  2NH3 (g)��ü�������H2��ת����Ϊ40%��
2NH3 (g)��ü�������H2��ת����Ϊ40%��
|
|
N2 |
H2 |
NH3 |
|
�� |
1 |
3 |
0 |
|
�� |
0.5 |
1.5 |
1 |
|
�� |
0 |
0 |
4 |
���ж��������з�Ӧ���еķ��� �������������
�ڴ�ƽ��ʱ���ס��ҡ�����������NH3�����������С˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
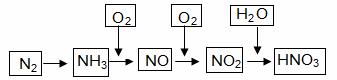
��ҵ��ͨ��������������Ӧ�ϳɰ�������һϵ�з�Ӧ���Եõ����ᡣ��Ӧ����ͼ��ʾ��
 |
��ش�
��1��NO2��H2O��Ӧ�еĻ�ԭ�������������������������� �� ��
��2��NH3��O2��ȡNO�Ļ�ѧ��Ӧ����ʽ������������������������������������������������������������������������ ���� ��
��3������˵������ȷ���ǣ�ѡ�������ĸ�������������������� ���� ��
a���������������
b���̬����һ�㲻������Ի��ʹ�ͬʹ��
c������������ƻ��ʡ�ũҩ��ըҩ��Ⱦ�ϡ������
d��ijŨ�����к�������2mol����״���£���Ũ������������ͭ��ȫ��Ӧ������1mol NO2
��4�������ŷź�N��P������ķ�ˮ���ᵼ��ˮ����Ⱦ�����к�����������Ҫ�ǵ����ʣ���������ˮ�зֽ������������������������������������Ӧ����HNO2�����������������ķ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ�������������������������� ���� ��
��5����֪��
H2(g) �� ![]() O2(g) �� H2O(g)������������������ ��H1 �� 241.8 kJ/mol
O2(g) �� H2O(g)������������������ ��H1 �� 241.8 kJ/mol
![]() N2(g) �� O2(g) �� NO2 (g)������������������ ��H2 �� +33.9 kJ/mol
N2(g) �� O2(g) �� NO2 (g)������������������ ��H2 �� +33.9 kJ/mol
![]() N2(g) ��
N2(g) �� ![]() H2(g) �� NH3 (g)���������������� ��H3 �� 46.0kJ/mol
H2(g) �� NH3 (g)���������������� ��H3 �� 46.0kJ/mol
��17g������������Ӧ����NO2��g����H2O��g��ʱ����H������ kJ/mol��
��6�������ǵ��ʹ�ҵ����Ҫԭ�ϣ�ij���ʳ������̬����(NH4) 2SO4�Ĺ����������£�
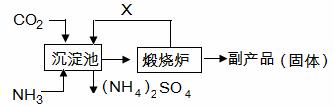 |
��װ��CaSO4����Һ�ij���������ͨ��������ͨCO2��ԭ���� ������������������������������������������������������������������ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com