
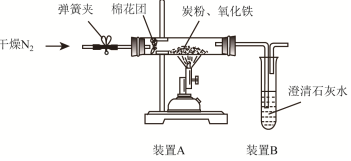
分析 (1)根据假设①②可以得出假设③的内容;
(2)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(5)①根据氢氧化钙和氢氧化钡的本质区别来思考;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物;
故答案为:CO2、CO的混合物;
(2)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的离子方程式为NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
故答案为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(4)3.20g氧化铁的物质的量为=3.2g÷160g/mol=0.02mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=2.0g÷100g/mol=0.02mol,m(CO2)=0.02mol×44g/mol=0.88g,
反应后硬质玻璃管和固体总质量变化为1.44g大于0.88g,则生成其气体为CO2、CO的混合物,混合气体中含有CO0.08mol,所以CO、CO2的混合气体物质的量比为4:1,所以方程式为5C+2Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe+4CO+CO2↑;
故答案为:5C+2Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$4Fe+4CO+CO2↑;
(5)①将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,称量时相对误差小;
故答案为:氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,碳酸钡的相对原子质量大于碳酸钙的,称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理;
故答案为:在尾气口处加一点燃的酒精灯.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质解题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向蛋白质溶液中加入浓氯化铁溶液 | |
| B. | 两种不同品牌的墨水混合 | |
| C. | 向饱和BaSO4溶液中加入浓BaCl2溶液 | |
| D. | 向饱和Na2CO3溶液中通入CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
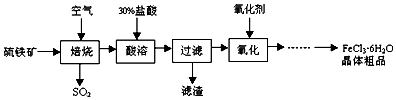
| A. | “焙烧”反应中,氧化产物是SO2,还原产物是Fe3O4 | |
| B. | “酸溶”时的酸可以用稀硫酸代替 | |
| C. | “过滤“后的滤液中Fe3+和Fe2+的浓度比为2:1 | |
| D. | “氧化”时的氧化剂只能选取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 金属单质 | 碱性氧化物 | 硝酸盐 | 非电解质 |
| 属于该类的物质(填序号) | ② | ③ | ⑥ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | H2S通入CuSO4溶液中:Cu2++S2-→CuS↓ | |
| C. | FeS固体放人稀盐酸溶液中:FeS+2H+→Fe2++H2S↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=0.3a,2Fe2++Cl2→2Fe3++2Cl- | |
| B. | x=0.7a,2Br-+Cl2→Br2+2Cl- | |
| C. | x=1.2a,2Fe2++2Br-+2Cl2→Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 将铜丝插入足量浓硝酸中:Cu+8H++2NO3-═3Cu2++2NO2↑+H2O | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+2AlO2-+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com