
| A、1个 | B、2个 | C、3个 | D、4个 |
科目:高中化学 来源: 题型:
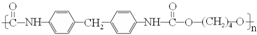 ),合成路线如图所示(部分反应试剂及生成物、条件省略).
),合成路线如图所示(部分反应试剂及生成物、条件省略).
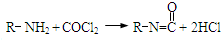
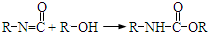
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
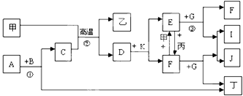 下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯 |
| B、用干燥的pH试纸分别测1mol?L-1的NaOH溶液和1mol?L-1的H2SO4的pH |
| C、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌 |
| D、向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
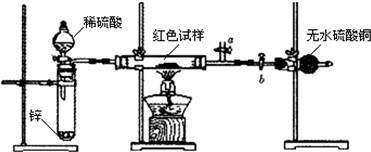 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com