
某无色透明溶液可能含有K+、Cu2+、Ca2+、SO42﹣、CO32﹣、Cl﹣中的几种,现进行如下实验:
(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出.
向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解.
(3)向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3.
试判断:该溶液中肯定有 离子,肯定没有 离子,可能有 离子(填离子符号).
写出步骤的离子方程式 .
考点: 常见离子的检验方法.
专题: 离子反应专题.
分析: 无色溶液中不会存在有色的Cu2+;生成的沉淀加入稀硝酸后部分溶解,则沉淀为BaSO4和BaCO3的混合物,原溶液中含有SO42﹣、CO32﹣,根据离子共存可知溶液中不会存在Ca2+;向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀为氯化银,由于(1)中加入氯化钡后引进了氯离子,则无法判断原溶液中是否含有氯离子;最后根据溶液为电中性可知一定含有K+,据此进行解答.
解答: 解:无色透明的溶液中不可能存在Cu2+,
滴加氯化钡溶液,有白色沉淀产生,生成的沉淀可能为BaSO4或BaCO3,其中BaCO3可溶于稀硝酸,将沉淀滤出,产生的沉淀可部分溶于稀硝酸,说明含有SO42﹣、CO32﹣离子,则一定不含Ca2+离子,根据溶液电中性原则,一定含有K+离子;
向滤液中加入硝酸银溶液,有白色沉淀生成,可能为Ag2SO4、Ag2CO3或AgCl沉淀,不能确定是否含有Cl﹣离子,
根据分析可知,溶液中一定含有的离子为:K+、SO42﹣、CO32﹣;一定不含的离子为:Cu2+、Ca2+;可能含有的离子为:Cl﹣;
步骤中碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水,反应的离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:K+、SO42﹣、CO32﹣;Cu2+、Ca2+;Cl﹣;BaCO3+2H+=Ba2++H2O+CO2↑.
点评: 本题考查了离子检验,题目难度中等,明确常见离子的性质及检验方法为解答关键,根据溶液电中性判断钾离子的存在为易错点,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:
某未知溶液中已检验出含有离子Ca2+、NO3﹣,且pH=2.欲检验此溶液中是否大量存在以下6种离子:①ClO﹣ ②NH4+③I﹣④Fe2+⑤AlO2﹣⑥Cl﹣,其中不必检验就能排除的离子是( )
A. ②③⑤⑥ B. ①③④⑤ C. ①④⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
含有Ag+、Al3+、Mg2+、Ba2+等四种金属离子的混合溶液.欲使上述四种离子分别以沉淀形式从溶液中分离出来.下列加入试剂的顺序能达到实验目的是( )
A. NaOH、NaCl、HCl、Na2SO4 B. NaCl、Na2SO4、NaOH、HCl
C. NaCl、NaOH、Na2SO4、HCl D. Na2SO4、NaOH、NaCl、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32﹣、Cl﹣、Mg2+中的一种或几种离子.
①向此溶液中滴加足量稀盐酸无明显现象.
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生.
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生.
(1)原溶液中一定含有的离子是 ,一定不含有的离子是 ,不能确定是否含有的离子是 .
②中反应的离子方程式为 .
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示).滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.

①OA段反应的离子方程式为 .②AB段反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按图所示的装置进行电解实验.下列说法正确的是()
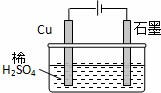
A. 电解过程中,铜电极上有H2产生
B. 电解一定时间后,石墨电极上有H2析出
C. 整个电解过程中,H+的浓度不断增大
D. 电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
配制0.1mol•L﹣1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘高,右盘低 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com