
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
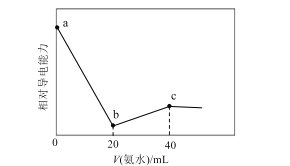
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
【答案】B
【解析】
a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,b点溶质为等浓度氯化铵和醋酸,c点溶质为等浓度氯化铵和醋酸铵,根据醋酸的电离平衡常数表达式,电荷守恒,物料守恒分析。
A.a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,盐酸全部电离,醋酸部分电离,根据醋酸的电离平衡表达式: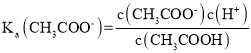 ;可以得到
;可以得到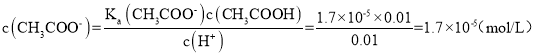 ,故A正确;
,故A正确;
B.Ka(CH3COOH)=1.7×10-5, ![]() ,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
C.点溶液中恰好生成等量的NH4Cl和CH3COONH4,根据物料守恒:2c(Cl)=c(NH4+)+c(NH3H2O),2c(CH3COOH)+2c(CH3COO)=c(NH4+)+c(NH3H2O),c(Cl)=c(CH3COO)+c(CH3COOH),所以有c(NH4+)+c(NH3H2O)=c(Cl)+c(CH3COO)+c(CH3COOH),故C正确;
D.c点溶质为等浓度氯化铵和醋酸铵,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5,即醋酸的酸性和氨水的碱性相当,在醋酸氨溶液中,铵根离子和醋酸根离子的水解程度相近,溶液呈中性,氯化铵属于强酸弱碱盐,显酸性,要让混合溶液pH=7即中性,加入氨水体积需大于40mL,故D正确;
答案选B。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:OH-、Na+、CrO![]() 、SO
、SO![]()
B.c(S2O![]() )=0.1mol·L-1的溶液中:Na+、K+、CO
)=0.1mol·L-1的溶液中:Na+、K+、CO![]() 、SO
、SO![]()
C.水电离出的c(H+)=1.0×10-13mol·L-1的溶液中:Na+、Mg2+、HSO![]() 、NO
、NO![]()
D.能使蓝色石蕊试纸变红的溶液中:Na+、NH![]() 、
、 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0] 是最简单的一种,结构简式如图。下列关于该化合物的说法错误的是
A.与1,3-丁二烯互为同分异构
B.一氯代物有2种,二氯代物共有4种(不考虑立体异构)
C.碳碳原子之间的夹角有45°和90°两种
D.与H2发生加成反应,生成1molC4H10理论上需要2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际贸易可以互通有无,符合国际社会的根本利益,下列贸易商品中,主要成分属于无机物的是
A.巴西铁矿砂 | B.沙特石油 | C.俄罗斯天然气 | D.中国丝绸 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是________反应(填反应类型,下同);与溴发生的反应是________反应。在一定的条件下,乙烯还能发生________反应,生成聚乙烯。
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成16 .8 L二氧化碳和13.5 g水。则该烃的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在探究淡黄色过氧化钠与水反应是放出热量还是吸收热量时设计了如图所示的实验装置。

在小试管里加入1g淡黄色过氧化钠,把小试管套在带支管的试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,可观察到U形管右侧的液面立即下降,左侧的液面上升。
(1)过氧化钠的电子式__。
(2)写出上述反应的化学方程式__。
(3)下列各图中,表示过氧化钠与水反应的图是(_______)
A.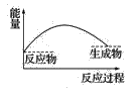 B.
B.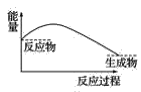
C.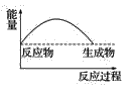 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属都能与氧气反应:
(1)已知1.4 g锂在空气中加热充分反应,可生成3.0 g氧化物,写出该反应的化学方程式: ______。
(2)将一小块金属钠、钾分别投入到加热的坩埚中,观察到的实验现象是____________,有关反应的化学方程式是______________。
(3)由上述实验得出的结论是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
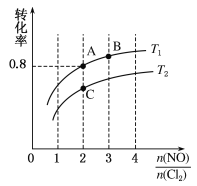
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com