
分析 (1)滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-,因为SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,根据离子共存的知识来确定溶液中的离子的存在与否;
(2)硝酸能将碘离子氧化,单质碘能使淀粉KI溶液呈蓝色来分析;
(3)根据氯离子的检验方法:加硝酸酸化的硝酸银后会产生白色沉淀,但要排除硫酸根的干扰;
(4)一氧化氮具有还原性,很容易被氧气氧化,二氧化氮能将二氧化硫氧化,根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用.
解答 解:(1)滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-,因为SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,因为硫酸根已经存在,
故答案为:SO42-、NO3-、NH4+;SO32-、NO2-;SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4溶液褪色;
(2)硝酸氧化碘离子的离子方程式为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O,故答案为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;
(3)氯离子的检验方法:加硝酸酸化的硝酸银后会产生白色沉淀,但要排除硫酸根的干扰;
故答案为:取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-;
(4)一氧化氮具有还原性,很容易被氧气氧化,方程式为:2NO+O2=2NO2,二氧化氮能将二氧化硫氧化,方程式为NO2+SO2=SO3+NO,整个过程一氧化氮的质量没有变化,故在反应中作催化剂,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂.
点评 本题是对离子共存知识以及离子的检验知识的考查,该题型是现在考试的热点和难点.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属与盐溶液的反应都是置换反应 | |
| B. | 阴离子都只有还原性 | |
| C. | 离子化合物中肯定存在离子键,可能不存在共价键 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
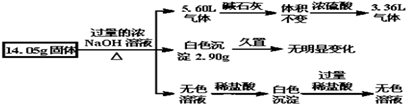
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
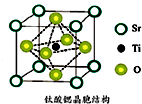 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.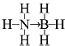 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl三种溶液的物质的量浓度关系为c(NH4HSO4)>c(NH4HCO3)>c(NH4Cl) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 室温下,向100mL0.1mol/LNaOH溶液中滴加0.1mol/LNH4HSO4溶液至溶液呈中性,溶液中各离子浓度大小关系:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
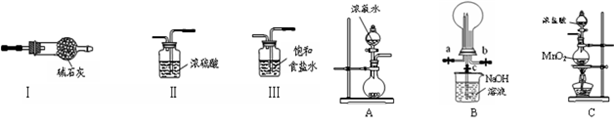
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com