
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
分析 根据n=cV分别计算出硝酸、硫酸的物质的量,然后计算出硝酸根离子、氢离子的物质的量,再根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O判断过量,最后根据不足量计算出生成一氧化氮的物质的量.
解答 解:在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量n(H2SO4)=0.1L×0.2moL/L=0.02moL,
所以氢离子的物质的量:n(H+)=0.04moL+2×0.04moL=0.08mol,
铜粉的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,
3 Cu+2 NO3-+8 H+=3Cu2++2NO↑+4H2O
3 2 8
0.03mol 0.02mol 0.08mol
硝酸根离子不足,需要根据H+计算生成NO的物质的量,所以完全反应生成一氧化氮的物质的量为=$\frac{2}{8}$×0.08mol=0.02mol,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,关键是把握反应的离子方程式,根据离子方程式判断反应的过量问题,侧重考查学生的分析理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | υ(A)=1.5 mol•L-1•s-1 | B. | υ(B)=0.5 mol•L-1•s-1 | ||
| C. | υ(C)=0.8 mol•L-1•s-1 | D. | υ(D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
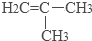 ;.
;.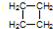 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为H2-2e-=2H+ | |
| B. | 在电池工作时,H+移向负极 | |
| C. | 电池正极发生氧化反应 | |
| D. | 以盐酸作为电解质溶液,并不断补充蒸馏水,以维持溶液一定的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol/L | B. | 0.15 mol/L | C. | 0.10 mol/L | D. | 0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:实验题
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L?1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L?1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L?1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42?,含有Cu+、Cu2+和SO32?。
已知:Cu+ Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+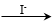 CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32?。
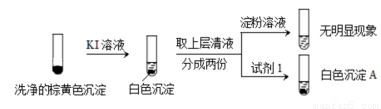
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32?的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42?,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:
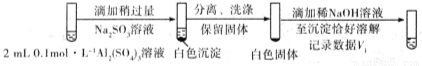
步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com