
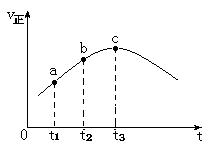
| A.反应在c点达到平衡状态 |
| B.反应物的浓度:a点大于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.逆反应速率:c点大于b点 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:不详 题型:填空题
 2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。
2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。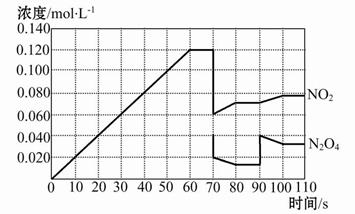
| A.加入催化剂 | B.扩大容器体积 |
| C.升高温度 | D.增大N2O4的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
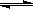 B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 和Cr
和Cr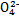 ),其流程为:Cr
),其流程为:Cr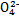
 Cr2
Cr2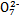
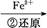 Cr3+
Cr3+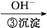 Cr(OH)3↓
Cr(OH)3↓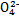 (黄色)+2H+
(黄色)+2H+ Cr2
Cr2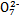 (橙色)+H2O
(橙色)+H2O Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr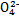 浓度增大 浓度增大 |
B.步骤①中当2v(Cr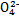 )=v(Cr2 )=v(Cr2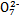 )时,说明反应2Cr )时,说明反应2Cr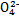 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2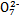 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2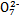 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是 | A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol/L | D.达到平衡时D的体积分数为20% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com