
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
分析 ①H2O(g)═H2O(l)△H1=Q1kJ•mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=Q2kJ•mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJ•mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
n(C2H5OH)=$\frac{46g}{46g/mol}$=1mol,结合物质的量与热量成正比计算.
解答 解:①H2O(g)═H2O(l)△H1=Q1kJ•mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=Q2kJ•mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJ•mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
n(C2H5OH)=$\frac{46g}{46g/mol}$=1mol,则46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为-(3Q1-Q2+Q3) kJ,
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意焓变与热量不同,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
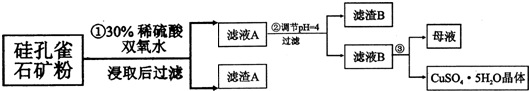
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
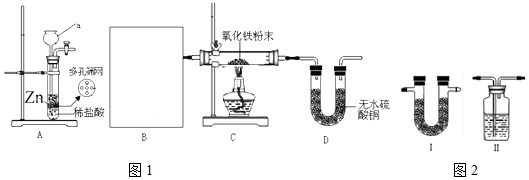
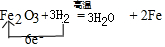 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com