
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
分析 A.石英玻璃的主要成分是二氧化硅;
B.分散系可分为溶液、浊液和胶体,浊液的分散质粒子大于溶液和胶体;
C.铁在空气中不能燃烧,而在氧气中燃烧生成四氧化三铁;
D.含氯消毒剂具有氧化性,能使蛋白质变性.
解答 解:A.分子筛的主要成分是硅酸盐,石英玻璃的主要成分是SiO2,是氧化物,不是硅酸盐,故A错误;
B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm,浊液的分散质粒子大于溶液和胶体,故B错误;
C.铁在空气中不燃烧,在纯氧中燃烧生成四氧化三铁,镁在空气在燃烧和氧气、氮气反应生成氧化镁、氮化镁,故C错误;
D.含氯消毒剂具有氧化性,可以选用含氯消毒剂对疫区可能的污染区域进行消毒预防,故D正确.
故选D.
点评 本题综合考查含硅物质的组成、物质的分类、铁、镁的性质、蛋白质的变性等知识,题目难度不大,侧重于基础知识的考查,注意基础知识的掌握.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
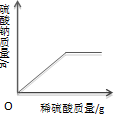 | 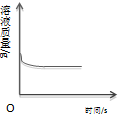 |  | 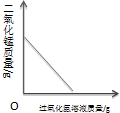 |
| A.向一定质量的氢氧化钠溶液中加入稀硫酸至过量 | B.向一定质量的稀硫酸中加入锌片 | C.加热一定质量的高锰酸钾固体 | D.向一定质量的二氧化锰中加入过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡比氢氧化钙的碱性强 | |
| B. | HBrO4的酸性比HIO4强 | |
| C. | 铍(Be)原子失电子的能力比镁弱 | |
| D. | 硒(Se)化氢的稳定性比硫化氢的稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
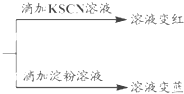
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
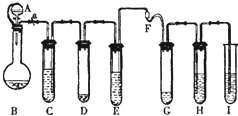 “化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:
“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
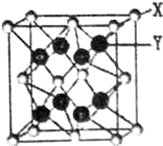 X与Y可形成离子化合物,其晶胞结构如下图所示.其中X离子的配位数为8,若该晶体的密度为pg•cm3,X和Y的相对原子质量分别为a和b,则晶胞中距离最近的X、Y之间的核间距离是$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$cm(NA表示阿伏伽德罗常数,用含p、a、b、NA的代数式表达).
X与Y可形成离子化合物,其晶胞结构如下图所示.其中X离子的配位数为8,若该晶体的密度为pg•cm3,X和Y的相对原子质量分别为a和b,则晶胞中距离最近的X、Y之间的核间距离是$\frac{{\sqrt{3}}}{4}×\root{3}{{\frac{4a+8b}{{ρ•{{N}_A}}}}}$cm(NA表示阿伏伽德罗常数,用含p、a、b、NA的代数式表达).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯化钾含有6.02×1023个KCl分子 | |
| B. | 6.02×1024个CO2分子的物质的量是1mol | |
| C. | 1molN2O4含有1molN2分子和4molO原子 | |
| D. | 1molH2分子和1molH2O分子所含的氢原子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com