
| A. | 两溶液中水的电离程度相同 | |
| B. | 盐酸溶液中c(Cl-)等于NaOH溶液中c (Na+) | |
| C. | 若两溶液等体积混合能恰好中和 | |
| D. | 分别稀释10倍后,两溶液的pH之和大于14 |
分析 常温下pH=2的盐酸溶液中c(H+)=0.01mol/L,c(OH-)=10-12mol/L,氢氧根全部来自水的电离,c(Cl-)+c(OH-)=c(H+);pH=12的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=10-12mol/L,c(OH-)=c(H+)+c(Na+),氢离子全部来自水的电离,据此分析.
解答 解:A、常温下pH=2的盐酸溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(OH-)=0.01mol/L,对水的电离的抑制程度相同,故两溶液中水的电离程度相同,故A正确;
B、常温下pH=2的盐酸溶液中c(H+)=0.01mol/L,c(OH-)=10-12mol/L,c(Cl-)+c(OH-)=c(H+),故c(Cl-)=c(H+)-c(OH-)=10-2mol/L-10-12mol/L=(10-2-10-12)mol/L;pH=12的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=10-12mol/L,c(OH-)=c(H+)+c(Na+),故c(Na+)=c(OH-)-c(H+)=(10-2-10-12)mol/L,故盐酸溶液中c(Cl-)等于NaOH溶液中c (Na+),故B正确;
C、常温下pH=2的盐酸溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(OH-)=0.01mol/L,故两溶液等体积混合后恰好完全中和,故C正确;
D、常温下pH=2的盐酸溶液稀释10倍后,溶液的pH=3,而pH=12的氢氧化钠溶液稀释10倍后,溶液的pH=11,故两溶液的pH之和为14,故D错误;
故选D.
点评 本题考查了溶液pH的有关计算和离子浓度的守恒以及溶液的稀释规律,难度不大,应注意的是酸和碱均抑制水的电离.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
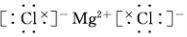 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是1 | B. | 质子数是2 | C. | 中子数是2 | D. | 电子数是1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2,3-二甲基-3-乙基丁烷 2,3-二甲基-3-乙基丁烷 | B. |  2,2,3,-四甲基己烷 2,2,3,-四甲基己烷 | ||
| C. |  对二甲苯 对二甲苯 | D. |  2,4,4-三甲基戊烯 2,4,4-三甲基戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O2 | B. | C2H4O2 | C. | C3H8O | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
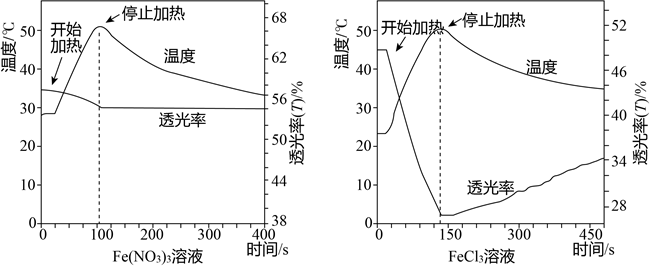
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com