
| A. | CaCl2和Na2S | B. | Na2O和Na2O2 | C. | CO2和NaCl | D. | HCl和NaOH |
科目:高中化学 来源: 题型:多选题
| A. | 在催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 葡萄糖与银氨溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
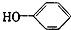 合成
合成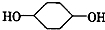 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)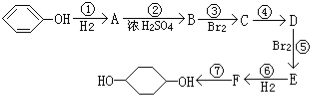
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.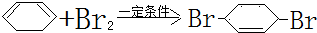 ,写出在同样反应条件下
,写出在同样反应条件下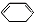 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)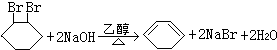 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ①⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
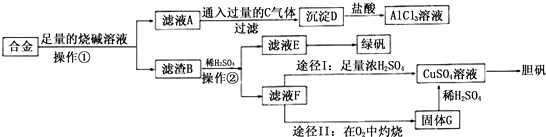
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA | |
| D. | 3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com