

 ��
�� ����ṹ��ʽ����
����ṹ��ʽ���� ���� E����Է�������Ϊ60��6.0gE�����ʵ�����0.1mol����ȫȼ�պ�����CO2�� H2O�����ʵ����ֱ�Ϊ $\frac{8.8g}{44g/mol}$=0.2mol��$\frac{3.6g}{18g/mol}$=0.2mol��������N��C��=$\frac{0.2mol}{0.1mol}$=2��N��H��=$\frac{0.2mol��2}{0.1mol}$=4����N��O��=$\frac{60-12��2-8}{16}$=2����E�ķ���ʽ��C2H4O2��AΪһȡ���������ɷ���ʽ��֪Ϊ����ͬϵ���AΪ ��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ
��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ
��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ ��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ
��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ ����GΪ
����GΪ ���ݴ˽��
���ݴ˽��
��� �⣺E����Է�������Ϊ60��6.0gE�����ʵ�����0.1mol����ȫȼ�պ�����CO2�� H2O�����ʵ����ֱ�Ϊ $\frac{8.8g}{44g/mol}$=0.2mol��$\frac{3.6g}{18g/mol}$=0.2mol��������N��C��=$\frac{0.2mol}{0.1mol}$=2��N��H��=$\frac{0.2mol��2}{0.1mol}$=4����N��O��=$\frac{60-12��2-8}{16}$=2����E�ķ���ʽ��C2H4O2��AΪһȡ���������ɷ���ʽ��֪Ϊ����ͬϵ���AΪ ��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ
��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ
��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ ��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ
��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ ����GΪ
����GΪ ��
��
��1��������������֪��E�ķ���ʽΪC2H4O2��
�ʴ�Ϊ��C2H4O2��
��2����B����C�Ļ�ѧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��3����B����D�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ����Ӧ����Ϊ���������ƴ���Һ�����ȣ�
����Ӧ����Ϊ���������ƴ���Һ�����ȣ�
C����D�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ����Ӧ����Ϊ��Ũ���ᡢ���ȣ�
����Ӧ����Ϊ��Ũ���ᡢ���ȣ�
�ʴ�Ϊ���������ƴ���Һ�����ȣ�Ũ���ᡢ���ȣ�
��4����A����B����ȡ����Ӧ����D����G���ڼӳɷ�Ӧ��
�ʴ�Ϊ��ȡ����Ӧ���ӳɷ�Ӧ��
��5����G�� ����ͬ���칹���У�������һ�����IJ���ֻ��һ�֣����к˴Ź�������������壬�ҷ������Ϊl��1�����ԶԳ��Ըߣ����Ժ���2����ͬ��ȡ�������Ҵ��ڶ�λ��Ϊ
����ͬ���칹���У�������һ�����IJ���ֻ��һ�֣����к˴Ź�������������壬�ҷ������Ϊl��1�����ԶԳ��Ըߣ����Ժ���2����ͬ��ȡ�������Ҵ��ڶ�λ��Ϊ ��
��
�ʴ�Ϊ��
���� ���⿼���л����ƶϣ��ؼ���ȷ��AΪ�ұ����ٽ��ת����ϵ������ʽ�ƶϣ���6����ͬ���칹����дΪ�״��㡢�ѵ㣬�Ѷ��еȣ�


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 40 K��40 Caԭ���е�������������������� | |
| B�� | ijԪ�������ֻ��һ�����ӣ�����һ���Ǣ�A��Ԫ�� | |
| C�� | �κ�ԭ�ӻ����ӵ�����ж��������� | |
| D�� | ͬλ�صIJ�ͬ������������ѧ������ȫ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | H3O+ | C�� | NH2- | D�� | F- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{a}{A+m}$��A-N+m�� | B�� | $\frac{a}{A}$��A-N�� | C�� | $\frac{a}{A+m}$��A-N�� | D�� | $\frac{a}{A}$��A-N+m�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ǧ���ص����һ�ε�� | |
| B�� | ������ӦʽΪPb-2e-�TPb2+ | |
| C�� | ������������Һ�����Խ���С | |
| D�� | �����У�ÿת��0.2 mol����ʱ��������������6.5 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������믣�XeF6�� | B�� | �����ᣨHClO�� | C�� | ������̼��CO2�� | D�� | ��������BF3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
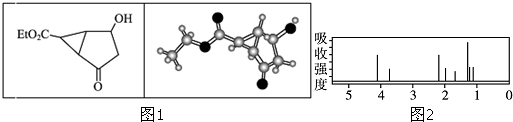
| A�� | ���л��ﲻͬ��ѧ��������ԭ����8�� | |
| B�� | ���л������ڷ����廯���� | |
| C�� | ����ʽ�е�Et�����Ļ���Ϊ-CH3 | |
| D�� | ���л���ķ���ʽΪC9H12O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ�ķ�Ӧ��Na+H2O=Na++OH-+H2�� | |
| B�� | ������ˮ��Ӧ��Cl2+H2O=2H++Cl-+ClO- | |
| C�� | ��FeCl3��Һ��ʴӡˢ��·�壺Fe++Cu=Fe2++Cu2+ | |
| D�� | ���������к�θ�Al��OH��3+3H+=Al3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��NO3-��CO32-��Na+ | B�� | Na+��I-��Cl-��SO42- | ||
| C�� | NO3-��Fe3+��Cl-��I- | D�� | NO3-��Cl-��Na+��SO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com