
 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.| 6.44kJ |
| 0.14mol |
| 3.1-x |
| 3.4 |
| x-0.3 |
| 3.4 |
| 0.6 |
| 3.4 |
| 0.3L |
| 1L |
| 6.44kJ |
| 0.14mol |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
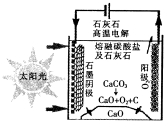 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业查看答案和解析>>
科目:高中化学 来源: 题型:
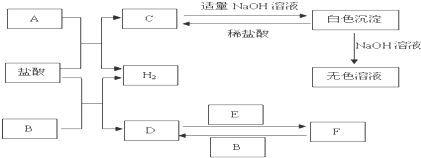
查看答案和解析>>
科目:高中化学 来源: 题型:
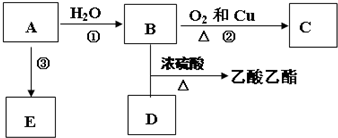
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com