
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
分析 A、液态KHSO4只能电离为钾离子和硫酸氢根离子;
B、正极消耗的氧气的状态不明确;
C、求出钠的物质的量,然后根据钠和酸溶液反应时,先和酸反应,即使当酸不足时,再和水反应,而钠和酸反应与和水反应的实质均相同;
D、求出铜的物质的量,然后根据当生成1mol铜时转移2mol电子来分析.
解答 解:A、液态KHSO4只能电离为钾离子和硫酸氢根离子,故0.05mol液态KHSO4中含0.05NA个阳离子,故A正确;
B、正极消耗的氧气的状态不明确,故氧气的物质的量无法计算,则转移的电子数无法计算,故B错误;
C、4.6g钠的物质的量为0.2mol,而钠和酸溶液反应时,先和酸反应,即使当酸不足时,再和水反应,而钠和酸反应与和水反应的实质均相同,即均为与氢离子的反应,而0.2mol钠能和0.2mol氢离子反应生成0.1mol氢气,故所得氢气分子个数为0.1NA个,故C正确;
D、32g铜的物质的量为0.5mol,而生成1mol铜时转移2mol电子,故当生成0.5mol铜时转移NA个电子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:推断题
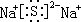 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
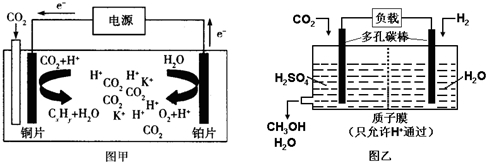
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol产物,转移的电子数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 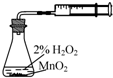 装置可测定化学反应速率 | |
| B. | 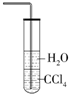 装置可用于吸收氨气,并防止倒吸 | |
| C. |  装置量取8.5 mL的稀硫酸 | |
| D. |  装置可制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com