
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.在化学反应中,原子首先失去的电子能量最低 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:填空题
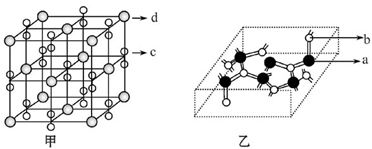
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
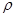 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。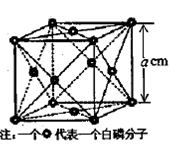
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.离子化合物中不可能存在共价键 |
| D.金属元素与非金属元素形成的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
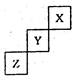
| A.相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B.由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C.ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D.Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
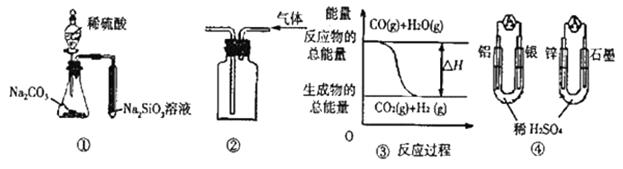
| A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图 ② 所示实验装置排空气法收集H2气体 |
C.图 ③ 表示可逆反应“CO(g)+H2O(g)  CO2(g)+H2(g)”为吸热反应 CO2(g)+H2(g)”为吸热反应 |
| D.图 ④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com