
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)+Q;Q>0,下列研究目的和示意图相符的是 ( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
|
| A. | A | B. | B | C. | C | D. | D |
| 化学平衡的影响因素;产物百分含量与压强的关系曲线;转化率随温度、压强的变化曲线;化学反应速率与化学平衡图象的综合应用.. | |
| 专题: | 化学平衡专题. |
| 分析: | A、合成氨反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析; B、合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析; C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析; D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析. |
| 解答: | 解:A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A错误; B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B错误; C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C正确; D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误; 故选C. |
| 点评: | 本题考查化学平衡与图象,明确影响化学反应速率及化学平衡的影响因素,图象中纵横坐标的含义即可解答. |


科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32—、SO32—、SO42—、C1—、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
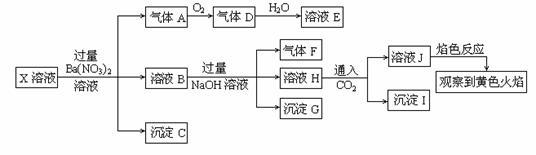
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42—
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+ 、Na+、K+和C1—
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物.
|
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L﹣1的Cu(NO3)2溶液、2.0mL 0.50mol•L﹣1的NaOH溶液和0.25mol•L﹣1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃ .
②80℃时,所制得的孔雀石有少量褐色物质的原因是 Cu(OH)2受热分解为CuO .
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
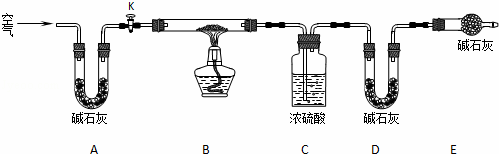
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4: 继续通一段时间空气至装置冷却 .
步骤5:称量相关装置的质量.
①装置A的作用是 除去空气中的CO2和H2O ;若无装置E,则实验测定的x/y的值将 偏小 (选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 BC、BD、CD (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 5Cu(OH)2•2CuCO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO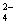 和CO
和CO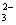
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子 B.Cl– 一定存在,且c(Cl–)≥0.4mol/L
C.SO42–、NH4+一定存在,Cl–可能不存在 D.CO32–、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是 ,还原剂是 。每生成1molNa2FeO4,转移 mol电子;
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式 ;
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),试分析原因。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com