
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A.NO:0.06mol•L﹣1  B.H2O:0.002mol•L﹣1
B.H2O:0.002mol•L﹣1
C.NH3:0.002mol•L﹣1 D.O2:0.00125mol•L﹣1
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨气:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH+H2O═AlO2-+H2↑ | |
| C. | 用浓NaOH溶液溶解Al2O3:Al2O3+2OH═2AlO2-+H2O | |
| D. | 向NaAlO2溶液中通入过量的CO2:2AlO2+CO2+3H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
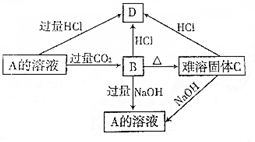
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=﹣a kJ•mol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
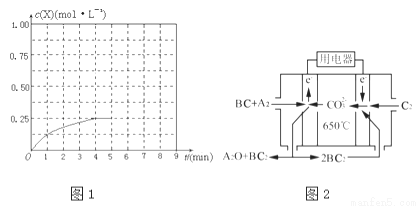
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:填空题
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“ 基本不变”)。
基本不变”)。
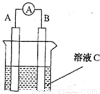
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流 ,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
室温下,用0.1 mol·Lˉ 1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
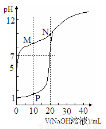
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1mol·L-1 的AlCl3溶液中,含Al3+数小于NA
B.标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
C.1mol NaBH4中含的离子的数目为6NA
D.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com