
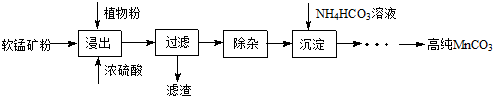
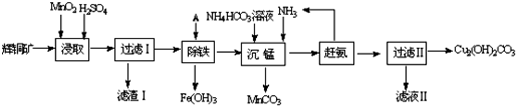
���� ʪ���������̿���Ҫ�ɷ�ΪMnO2��������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣�
��1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ�
��3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=1.8��10-11/1.0��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10-5/1.8��10-6=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��
��� �⣺��1�����¡����趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�����ֲ�����һ�ֻ�ԭ����
�ʴ�Ϊ��������̿����̵Ľ����ʣ�����ԭ����
��2��ʹ��̼���̵�pH�������Dz������µ����ʣ�������Һ�ж�������������������Ϊ��������������ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++2H2O+O2����
�ʴ�Ϊ������MnCO3�IJ������������µ����ʵȣ��� MnO2+H2O2+2H+=Mn2++2H2O+O2����
��3������̼����������ֽ�������¶ȿ���35�����µ�ԭ���Ƿ�ֹ̼����立ֽ⣬��30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��MnSO4+2NH4HCO3 $\frac{\underline{\;30��-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
�ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 $\frac{\underline{\;30��-35��\;}}{\;}$MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���
��4��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��1{0}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��$\frac{2.6��1{0}^{-5}}{1.8��1{0}^{-6}}$=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��Ksp ��MnCO3��=c��Mn2+��•c��CO32-������Mn2+������ȫʱ��c��CO32-��=$\frac{1.8��1{0}^{-11}}{1.0}$��10-5=1.8��10-6 mol•L-1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��$\frac{2.6��1{0}^{-5}}{1.8��1{0}^{-6}}$=14.4 mol•L-1��Mg2+��Ũ��0.01mol/LԶС��14.4 mol•L-1��������Һ�е�c��Mg2+��=10-2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
���� ���⿼����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬�������̷������������뷽���������ķ�ӦΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ��������3.36 L��������һ����2.7 g������ | |
| B�� | �⻯�Ҳ��һ�ִ�����ϣ�����ԭ��ΪLiH+H2O�TLiOH+H2�� | |
| C�� | ���ɵ���������������Ӧ�١���ת�Ƶ�����֮��Ϊ4��3 | |
| D�� | LiAlH4�ǹ��ۻ����LiH�����ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
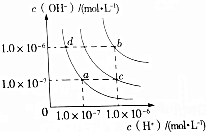
| A�� | a���Ӧ�¶������£���pH=x�İ�ˮϡ��10������pH=y����x=y+1 | |
| B�� | ��ˮ�������¶ȣ��ɴ�d��䵽b�� | |
| C�� | c���Ӧ�¶������´���ĵ��볣����a���Ӧ�¶������´���ĵ��볣���� | |
| D�� | b���Ӧ�¶������£�0.5mol•L-1��H2SO4��Һ��1mol•L-1��KOH��Һ�������ϣ���ַ�Ӧ��������Һ��c��H+��=10-7mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
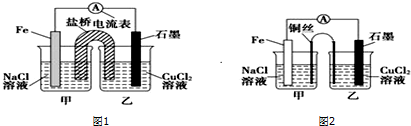
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�ð��ǵ���Ҫ�ɷ��������� | |
| B�� | �ԡ��ع��͡����з���ɵõ����� | |
| C�� | NH3��Һ������������� | |
| D�� | �����ֺ�����������Ա��������������ˮ��������ɱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
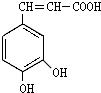 �����ᣨ�ṹ��ͼ��������������ҩ�У���Ұ���ܲ�����Ҷˮ�ա�����ľ���ĵȣ���������ֹѪ���ã��ر�������ֹѪЧ���Ϻã�
�����ᣨ�ṹ��ͼ��������������ҩ�У���Ұ���ܲ�����Ҷˮ�ա�����ľ���ĵȣ���������ֹѪ���ã��ر�������ֹѪЧ���Ϻã� ��
��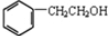 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����10.0mL | B�� | ��10.0mL | C�� | ����10.0mL | D�� | ����11.0mL |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com