
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=______________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是__________。
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:


下列叙述错误的是( )
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
某充电电池的原理如图186所 示,
示, 溶液中c(H+)=2.0 mol·L-1,阴离子为SO
溶液中c(H+)=2.0 mol·L-1,阴离子为SO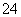 ,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )
,a、b均为惰性电极,充电时,右槽溶液的颜色由绿色变为紫色。下列对此电池叙述正确的是( )

图186
A.放电过程中,左槽溶液的颜色由黄色变为蓝色
B.充电过程中,a极的反应式为VO +2H++e-===VO2++H2O
+2H++e-===VO2++H2O
C.充电时,b极接直流电源的正极,a极接直流电源的负极
D.放电时,当转移1.0 mol电子时,共有2.0 mol H+从右槽迁移至左槽
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是( )
A、该反应中肼作还原剂
B、液态肼的燃烧热为20.05 kJ·mol-1
C、该动力源的突出优点之一是生成物对环境污染小
D、肼和过氧化氢反应的热化学方程式为:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四种金属。将a与b连接起来,浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应强烈。将铜浸入b的盐溶液里,无明显变化。如果把铜浸入c的盐溶液里,有金属c析出。据此判断它们的活动性顺序由强到弱的为( )
A.a > c > d > b B.d > a > b > c
C.d > b > a > c D.b > a > d > c
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.氯碱工业中常用离子交换膜法电解制碱(如图1所示)。
(1)写出图1中阴极的电极反应式 。
 (2)已知阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。工业上若用图2装置电解饱和Na2SO4溶液来生产纯净的NaOH和H2SO4,则该装置最主要的缺陷是 。
(2)已知阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。工业上若用图2装置电解饱和Na2SO4溶液来生产纯净的NaOH和H2SO4,则该装置最主要的缺陷是 。
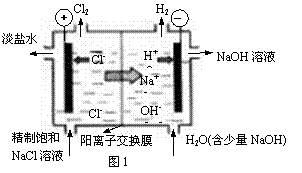

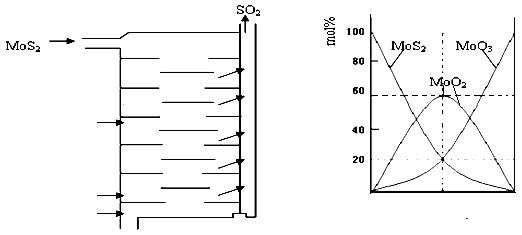
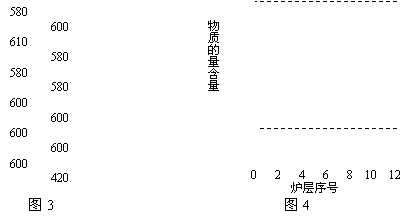
Ⅱ.辉钼矿(MoS2)是一种重要的矿物。图3是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图4给出了各炉层固体物料的物质的量百分含量。
|
 | |||
 | |||
(1)验证辉钼矿焙烧生成的气体是SO2而不是SO3的方法是 。
(2)辉钼矿焙烧生成的气体能使硫酸酸化的KMnO4溶液褪色,用化学方程式表示褪色的原因 。
(3)第6炉层存在的固体物质分别是MoS2、MoO3、MoO2,则它们的物质的量之比为 。
(4)图4表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的热化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O2  2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
A.0.1s B.2.5s C.5s D.10s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中,正确的是
A.往容积一定的容器中再通入O2,可以加快反应2SO2+O2 2SO3的反应速率
2SO3的反应速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.对于C(s)+H2O(g)  CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com