
分析 (1)光束通过胶体时,产生光亮的通路,称为丁达尔效应;
(2)先根据二价金属A的氯化物的分子式,由Cl-的物质的量求出氯化物的物质的量,再根据公式M=$\frac{m}{n}$来确定分子的摩尔质量;
(3)依据n=$\frac{m}{M}$=$\frac{V}{22.4}$计算摩尔质量分析判断气体;
(4)在标准状况下,15gCO和CO2的混合气体的体积为11.2L,物质的量为0.5mol,令一氧化碳的物质的量为xmol,二氧化碳的物质的量为ymol,列方程计算x、y的值,在根据N=nNA计算CO和CO2的分子数之比,进行判断;
(5)根据n=$\frac{V}{{V}_{m}}$计算224LHCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据ω(HCl)=$\frac{HCl的质量}{溶液质量}$×100%计算盐酸的质量分数,再根据c=$\frac{1000ρw}{M}$计算盐酸的物质的量浓度;
(6)电解质是水溶液中或熔融状态下导电的化合物,据此分析;
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合,氢氧化钠全部反应,离子方程式中氢氧根离子前的系数为1,结合原子守恒和电荷守恒配平书写.
解答 解:(1)光束通过胶体时,产生光亮的通路,称为丁达尔效应,是胶体的特征性质,故答案为:丁达尔效应;
(2)因某二价金属的氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,则M(ACl2)=$\frac{m}{n}$=$\frac{19g}{0.2mol}$=95g/mol,
故答案为:95g/mol;
(3)在标准状况下,测得4.2g气体A的体积是3360mL,M=$\frac{m}{\frac{V}{22.4}}$=$\frac{4.2g}{\frac{3.36L}{22.4L/mol}}$=28g/mol,则返回的气体可能为N2 或者 CO或C2H4,
故答案为:N2 或者 CO或C2H4;
(4)在标准状况下,15gCO和CO2的混合气体的体积为11.2L,物质的量为0.5mol,
令一氧化碳的物质的量为xmol,二氧化碳的物质的量为ymol,则
xmol+ymol=0.5mol,
xmol×28g/mol+ymol×44g/mol=15g,
解得,x=$\frac{7}{16}$,y=$\frac{1}{16}$.
CO2和CO的体积之比是1:7,
故答案为:1:7:
(5)标准状况下,将224L HCl气体的物质的量为$\frac{224L}{22.4L/mol}$=10mol,故HCl的质量为10mol×36.5g/mol=365g,
635mL水的质量为635mL×1g/mL=635g,故HCl的质量分数为$\frac{365g}{365g+635g}$×100%=36.5%,
故所得盐酸的物质的量浓度为$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
故答案为:11.8mol/L;
(6)①NaCl晶体溶于水溶液导电,则氯化钠晶体为电解质;
②盐酸是氯化氢水溶液属于混合物,不是电解质;
③CaCO3固体熔融状态导电属于电解质;
④熔融KCl 能发生电离出离子,能导电属于电解质;
⑤蔗糖不能电离属于非电解质;
⑥铜是单质不是电解质;
⑦CO2 本身不能电离出离子属于非电解质;
⑧浓H2SO4 是硫酸溶液属于混合物,不是电解质;
⑨KOH固体溶于水电离出离子溶液导电,固体KOH为电解质;
以上物质中属于电解质的是①③④⑨,
故答案为:①③④⑨;
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合,氢氧化钠全部反应,离子方程式中氢氧根离子前的系数为1,离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O.
点评 本题考查了胶体性质、离子方程式书写,物质的量、物质的量浓度、气体摩尔体积的计算、电解质概念理解,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 [加成反应]
[加成反应]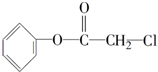 与NaOH溶液共热:
与NaOH溶液共热: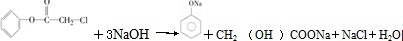 [取代反应].
[取代反应].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第14列元素的最高价氧化物的化学式为RO2 | |
| B. | 第2列元素中一定没有非金属元素 | |
| C. | 在18列元素中,第3列元素种类最多 | |
| D. | 第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com