
| 28.7g |
| 143.5g/mol |
| 6.40g |
| 160g/mol |


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有_____________________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂______________和____________。
(3)实验2通入足量Cl2的目的是________________________________;涉及的化学反应的离子方程式是______________________________。
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是_________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)。________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是________________。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)
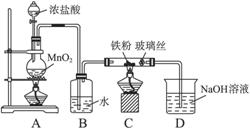
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为_________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
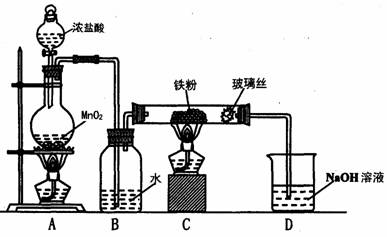
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________________________________________________。
(2)实验室保存。FeCl2溶液时通常会向其中加入少量试剂______________和_____________。
(3)实验2中通人足量Cl2的目的是__________________________________________________。
涉及的化学反应的离子方程式是___________________________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法_______________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)___________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是___________(填写序号字母)。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为____________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
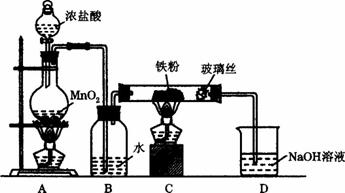
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com