
如右图所示组装一个原电池装置,可观察到的现象是 。其中 锌是 极。
锌是 极。
电极反应式为:正极:
负极:
电池反应为
一般来说,电池的极化作用都是很强的,极化作用会使电池的放电和充电变得迟钝。所以上述电池在工作较短的时间后,灯泡会熄灭。当加入一些高锰酸钾、重铬酸钾或双氧水等强氧化剂时,现象又会变得明显,原因是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014届四川省攀枝花市高三第一次统考化学试卷(解析版) 题型:选择题
电池是应用广泛的能源。
(1)设计两种类型的原电池,比较其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见右图),并作相应标注。
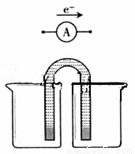
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙。
③甲、乙两种原电池中乙的能量转化效率较低,其原因是 。
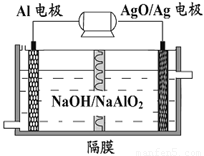
(2)Al-AgO电池可作用水下动力电源,其原理如图所示。其中的隔膜属于 (填“阴”或“阳”)离子交换膜。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,写出该电池正负极电极反应:负极 ,正极 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com