
| A. | 大部分蔬菜和水果属于碱性食物 | B. | 大米和面粉属于酸性食物 | ||
| C. | 牛奶遇碘水变蓝色 | D. | 鸡蛋和牛奶含有较多蛋白质 |
分析 A、食品的酸碱性与其本身的pH值无关(味道是酸的食品不一定是酸性食品),主要是食品经过消化、吸收、代谢后,最后在人体内变成酸性或碱性的物质来界定;
B、大米和面粉是淀粉类,属于酸性食物;
C、牛奶的主要成分是蛋白质;
D、鸡蛋和牛奶的主要成分为蛋白质,据此解答即可.
解答 解:A、含钾、钠、钙、镁等矿物质较多的食物,在体内的最终的代谢产物常呈碱性,产生碱性物质的称为碱性食品,蔬菜、水果、乳类、大豆和菌类食物等,故A正确;
B、含氮、碳、硫、氯、等元素较多的食物,经过消化形成酸根留在体内,产生酸性物质的称为酸性食品,如淀粉类,故B正确;
C、牛奶主要成分为蛋白质,蛋白质遇碘不变蓝色,淀粉遇碘变蓝色,故C错误;
D、鸡蛋和牛奶均属于动物蛋白,含有蛋白质成分较高,故D正确,
故选C.
点评 本题主要考查了酸性食物和碱性物质的概念、淀粉的特性(遇碘变蓝),还要熟知生活中常见营养物质的成分,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 油酸和水、甲苯和水、己烷和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、CO32-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | NH4+、K+、MnO4-、SO42- | D. | Ca2+、Na+、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 降低温度 | ||
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: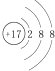 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com