
分析 (1)电池是将化学能转化为电能的装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,在得失电子相等的条件下,将正负电极上电极反应式相加即得电池反应式;
(2)根据电池反应式知,锌失电子发生氧化反应而作负极,氧气在正极得电子发生还原反应,根据电极反应式计算.
解答 解:(1)根据电池总反应为Ag2O+Zn=2Ag+ZnO,据此判断Ag2O是正极,电极反应式为Ag2O+H2O+2e-=2Ag+2OH-;Zn是负极,电极反应式为Zn+2OH--2e-=ZnO+H2O,电解质溶液中OH-移向负极,
故答案为:正;Ag2O+2e-+H2O=2Ag+2OH-;负;Zn-2e-+2OH-=ZnO+H2O;负;
(2)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e-═2H2O,若电池工作过程中有5.6L O2(标准状况下)即$\frac{5.6L}{22.4L/mol}$=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;
故答案为:2Zn-4e-═2Zn2+;O2+4H++4e-═2H2O;1mol.
点评 本题考查原电池以及氢氧燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
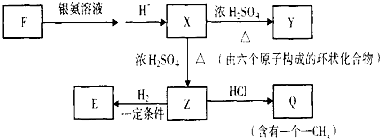
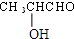
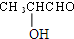 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$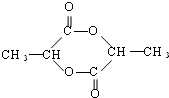 +2 H2O
+2 H2O查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
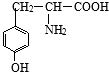 有一种结构简式如图的有机物,请回答下列问题:
有一种结构简式如图的有机物,请回答下列问题: +2NaOH→
+2NaOH→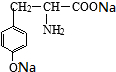 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含有Cl2和H2O两种物质 | |
| B. | 新制氯水可以使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,逸出的气体只有氯气 | |
| D. | 氯水放置数天后酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com