
分析 (1)根据m=nM计算质量,结合原子的结构特点计算微粒数目;
(2)同温同压下,气体摩尔体积相等,如果C18O和氢气的体积相等,则二者的物质的量相等,根据m=nM、ρ=$\frac{M}{{V}_{m}}$计算其质量之比、密度之比,如果二者质量相等,根据V=$\frac{m}{M}$计算其体积之比;
(3)相对原子质量=$\frac{1个原子的质量}{{\;}^{12}C质量的\frac{1}{12}}$或数值上与NA个R原子的质量的数值相同,以此来解答.
解答 解:(1)m(NH4+)=1mol×18g/mol=18g,其中含质子、中子、电子的数目分别为11 NA(或6.622 X1024)、7NA(或4.214.X1024)、,
故答案为:18g;11 NA(或6.622 X1024);7NA(或4.214.X1024);10NA(或6.02 X1024);
(2)同温同压下,气体摩尔体积相等,如果C18O和氢气的体积相等,则二者的物质的量相等,C18O的摩尔质量是30g/mol、2H2的摩尔质量是4g/mol,根据m=nM知,相同物质的量时,二者的质量之比等于其摩尔质量之比,为30g/mol:4g/mol=15:2;
根据ρ=$\frac{M}{{V}_{m}}$知,气体摩尔体积相等时,二者的密度之比等于其摩尔质量之比=30g/mol:4g/mol=15:2;
如果二者质量相等,根据V=$\frac{m}{M}$知,相同气体摩尔体积时,其体积之比等于摩尔质量的反比=4g/mol:30g/mol=2:15,
故答案为:15:2;15:2;2:15;
(3)某原子的质量为ag,1个12C原子的质量为bg,则R原子相对原子质量=$\frac{1个原子的质量}{{\;}^{12}C质量的\frac{1}{12}}$=$\frac{12a}{b}$,若阿伏加德罗常数的值为NA,则R的摩尔质量为aNAg/mol,故其相对原子质量为aNA,
故答案为:$\frac{12a}{b}$或aNA.
点评 本题考查物质的量的计算,为基础性习题,把握质量、物质的量、摩尔质量的关系为解答的关键,侧重分析能力和计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 | |
| D. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
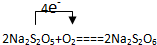 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系一定是混合物 | |
| B. | 胶体的分散质不能透过滤纸 | |
| C. | 任何物质在水中都有一定的溶解度 | |
| D. | 胶体和其它分散质的本质区别是能发生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 氨水浓度/(mol•L-1) | 盐酸浓度/(mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 正反应速率等于逆反应速率,且都为零 | |
| B. | 反应物和生成物浓度相等 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 断开化学键吸收的能量等于形成化学键所放出的能量. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能与所有的酸和碱反应放出氢气 | |
| B. | 用酒精灯外焰加热铝箔,可以看到少量液滴悬而不落,说明铝的熔点比氧化铝高 | |
| C. | 铝合金质轻,强度大,耐腐蚀,可以用作门窗 | |
| D. | 氢氧化铝能溶于氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com