
【题目】下列说法不正确的是( )
A.电子构型为[Ar]3d104s2的元素是过渡金属元素
B.某基态原子3d能级中电子排布的情况可能为![]()
C.在氢原子的电子云图中,每个小黑点代表一个电子
D.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】(1)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有好的电学性能。下列说法正确的是_____ (填序号)。
A.金属Ca、Sr、Ba采用体心立方堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
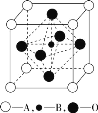
(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构如图所示。
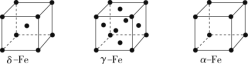
①γ—Fe晶胞中含有的铁原子数为_____。—
②δ—Fe、α—Fe两种晶体中铁原子的配位数之比为_____。
③若α—Fe晶胞的边长为acm,γ—Fe晶胞的边长为bcm,则两种晶体的密度之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍(NiSO4)是电镀镍工业所用的主要镍盐,易溶于水。下图为某兴趣小组设计的在实验室中
制备 NiSO46H2O 的装置。

回答下列问题:
(1)实验室中配制浓 H2SO4 与浓 HNO3 混酸的操作为______。
(2)图甲中仪器 a 的名称为__________,有同学认为将仪器 a 换作图乙中的仪器 b 效果更好,其理由 为______。
(3)混酸与镍粉反应时,除生成 NiSO4 外,还生成了 NO2、NO 和 H2O,若 NO2 与 NO 的物质的量之比为 1∶1,则该反应的化学方程式为______。从反应后的溶液中得到 NiSO46H2O 的操作有_____和过滤、洗涤、干燥。
(4)该小组同学查阅资料发现用镍粉与混酸制备 NiSO4 成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取 NiSO4 成本较低。反应原理为:NiC2O4![]() NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:
NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:

①各装置的连接顺序为:_____→______→_______→ f →_____→_____→_____。(填装置 标号,可重复使用)
②能够说明生成 CO 的现象有______。
③PdCl2 溶液吸收 CO 时产生黑色金属单质和 CO2 气体,该反应其他产物的化学式为______________________。
(5)将 NiSO46H2O 制成电镀液时往往加入少量稀硫酸,其目的是___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见含硫物质A~D,在生活、生产中有着广泛应用,它们之间的转化关系如下图所示。其中反应①、②中所需物质B溶液的浓度不同。

请按要求回答下列问题:
(1)A的化学式为_______。
(2)反应①、②中Cu、Fe所起的作用相同,即都作_______(填“氧化剂”或“还原剂”),你判断的依据是它们都是金属,在反应中都_______。
(3)反应②的离子方程式为_______。
(4)大气中因废气A引起酸雨的反应流程之一可用下图示意:

上图中由D→B的转化所需氧化剂为_______。
当将含D的雨水敞口放置一段时间后(忽略溶液体积、温度的变化),其c(H+)将_______。(填“增大”“减小”或“不变”)。废气A是一种重要的化工原料,常采用氨吸收法进行循环利用、变废为宝。某工厂若将4.48×106L(标准状况下)废气A进行环保处理,完全转化为 NH4HSO3时,需消耗10mol/L氨水溶液(溶质全部以NH3H2O计)的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是

A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-38 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为:___。
(2)维持电流强度为0.5A,电池工作十分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过__分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是___。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为__,加碱调节至pH为__时,铁刚好完全沉淀;继续加碱调节至pH为___时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是___,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
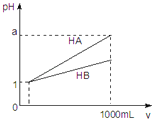
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F可用于某抗凝血药的制备,工业生成F的一种路线图如下(其中H与FeCl3溶液能发生显色反应):
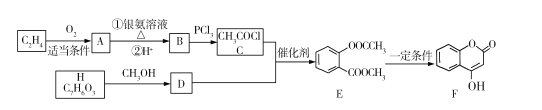
回答下列问题:
(1)A的名称是 ___,E中的官能团是名称是____。
(2)B→C的反应类型是 ___,F的分子式为____。
(3)H的结构简式为 ___。
(4)E与NaOH溶液反应的化学方程式为 ___。
(5)同时满足下列条件的D的同分异构体共有____种,写出核磁共振氢谱有5组峰的物质的结构简式 ___
①是芳香族化合物
②能与NaHCO3溶液反应
③遇到FeCl3溶液不显色
④1mol该物质与钠反应时最多可得到1molH2
(6)以2氯丙酸、苯酚为原料制备聚丙烯酸苯酚酯(![]() ),写出合成路线图(无机试剂自选)_________。
),写出合成路线图(无机试剂自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。工作原理如图所示,下列有关该二次电池说法正确的是( )

A.该电池放电时,C1-向下层方向移动
B.充电时,阴极的电极反应为:Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层做阴极
D.放电时,Mg(液)层的质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com