
| X | ||
| Y | ||
| Z |
| A. | Y元素原子的外围电子排布为4s24p4 | |
| B. | Y元素在周期表的第三周期第ⅥA族 | |
| C. | X元素所在周期中所含非金属元素最多 | |
| D. | Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
分析 Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素,以此解答该题.
解答 解:Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素,
A.Y元素原子的外围电子排布为ns(n-1)np(n+1),s能级最多容纳2个电子,故n-1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故A错误;
B.Y为S元素,处于第三周期第ⅥA族,故B正确;
C.X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;
D.Z为As元素,是33号元素,其元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确.
故选A.
点评 本题考查结构与位置关系、核外电子排布规律、元素周期表等,难度不大,推断Y元素是解题的关键,注意基础知识的掌握.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:填空题
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中, 振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 其他条件不变时,升高温度,化学反应速率加快 | |
| B. | 其他条件不变时,增大浓度,化学反应速率加快 | |
| C. | 化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 | |
| D. | 化学反应的限度是不可以改变的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 难溶电解质 | NiS | CuS | Cu(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp或沉淀完全的pH | 1.1×10-21 | 1.3×10-36 | pH=9 | pH=9.5 | pH=3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有6种 | |
| B. | 与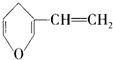 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 | |
| C. | 已知丁基共有四种.不必试写,立即可断定分子式为C5H10O的醛应有4种 | |
| D. | 菲的结构简式为 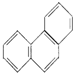 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
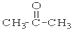 ③CH3CH2Br ④
③CH3CH2Br ④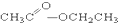 ⑤
⑤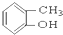 ⑥
⑥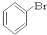 ⑦
⑦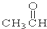 ⑧
⑧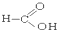 ⑨
⑨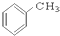 ⑩
⑩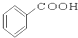
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电器中的金属材料 | B. | 防止电器造成污染 | ||
| C. | 废电器经过处理后还可以重新使用 | D. | 回收其中非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com