
|
下列工业生产的主要反应原理不涉及氧化还原反应的是 | |
| [ ] | |
A. |
硝酸工业 |
B. |
接触法制硫酸 |
C. |
合成氨工业 |
D. |
氨碱法制纯碱 |
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
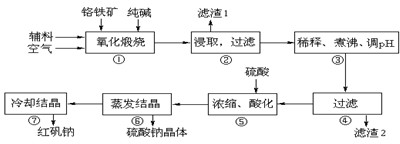
| ||
| ||
| ||
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
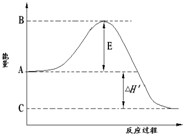 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:| 1 |
| 3 |
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com