
【题目】(1)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1,2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1,由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4 的反应。已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1,温度为T时,该反应的热化学方程式为__________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1 480 kJ·mol-1,FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。
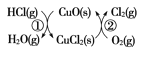
(4)用O2将HCl转化为Cl2,可提高效益,减少污染。 传统上该转化通过如图所示的催化循环实现,其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
【答案】Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH=-206 kJ·mol-1 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1 2HCl(g)+1/2O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2
【解析】
根据盖斯定律分析解答(1)~(3);
(4)由图示可知,先写出反应②的热化学方程式,再根据盖斯定律分析解答。
(1)①Al2O3(s)+3C(s)═2Al(s)+3CO(g) △H1=+1344.1kJmol-1,②2AlCl3(g)═2Al(s)+3Cl2(g) △H2=+1169.2kJmol-1,由盖斯定律可知,①-②得到Al2O3(s)+3C(s)+3Cl2(g)═2AlCl3(g)+3CO(g),△H=(+1344.1kJmol-1)- (+1169.2kJmol-1)=+174.9kJ/mol,即热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)═2AlCl3(g)+3CO(g) △H=+174.9kJ/mol,故答案为:Al2O3(s)+3C(s)+3Cl2(g)═2AlCl3(g)+3CO(g) △H=+174.9kJ/mol;
(2)由题意知①CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165kJmol-1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H= -41kJmol-1;根据盖斯定律,由②-①可得CO、H2合成CH4的反应:CO(g)+3H2(g)═CH4(g)+H2O(g)△H= -206kJmol-1,故答案为:CO(g)+3H2(g)═CH4(g)+H2O(g)△H= -206kJmol-1;
(3)FeCO3在空气中加热发生氧化还原反应可制得铁的氧化物,发生的反应为:4FeCO3+O2![]() 2Fe2O3+4CO2。①4Fe(s)+3O2(g)═2Fe2O3(s)△H= -1648kJ/mol,②C(s)+O2(g)═CO2(g)△H= -393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H= -1480kJ/mol,根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)= -260kJ/mol,故反应的热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H= -260kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H= -260kJ/mol;
2Fe2O3+4CO2。①4Fe(s)+3O2(g)═2Fe2O3(s)△H= -1648kJ/mol,②C(s)+O2(g)═CO2(g)△H= -393kJ/mol,③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H= -1480kJ/mol,根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)= -260kJ/mol,故反应的热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H= -260kJ/mol,故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H= -260kJ/mol;
(4)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s)H2O(g)+CuCl2(s) △H1,反应②生成1molCl2(g)的反应热为△H2,则反应的热化学方程式为:CuCl2(g)+![]() O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)或2HCl(g)+
O2(g)=CuO(s)+Cl2(g) △H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=2(△H1+△H2)或2HCl(g)+![]() O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2,故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)或2HCl(g)+
O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2,故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)或2HCl(g)+![]() O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2。
O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
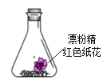
【题目】锥形瓶中装有部分变质的漂粉精粉末和红色纸花,向其中注射浓盐酸,观察到纸花褪色,并有黄绿色气体生成,该实验可以得到的结论是( )
A.说明![]() 具有漂白性B.实验中只发生了氧化还原反应
具有漂白性B.实验中只发生了氧化还原反应
C.浓盐酸被氧化D.反应中生成的气体只有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:![]() ,用0.1mol/L盐酸滴定20mL 0.1mol/L
,用0.1mol/L盐酸滴定20mL 0.1mol/L![]() 溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )

A.B点对应的溶液中![]()
B.C点对应的溶液中![]()
C.A到C溶液中,![]() 电离常数不变
电离常数不变
D.由A到D,水电离出的![]() 先减小后增大
先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、镁、铝、铁是四种重要的金属。请回答:
(1)钠的金属活动性比铝的________(填“强”或“弱”)。
(2)钠与水反应,可观察到的实验现象是________(填编号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。
(4)写出铁与水蒸气在高温时反应的化学方程式____________
(5)将镁铝合金与过量NaOH溶液反应,所得溶液中不存在的离子是________。
A.Na+ B.Mg2+ C.OH- D.AlO2-
(6)将镁铝合金溶于过量的盐酸中,充分反应后,溶液中新生成的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略)
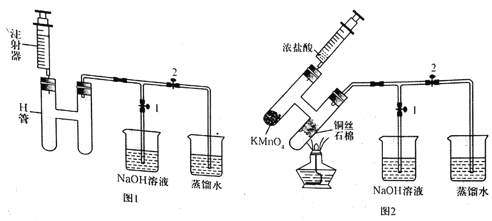
步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。
步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约![]() 处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。
待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。
(1)检验图1所示装置气密性时的操作方法是______。反应过程中将H管倾斜放置的目的是_________(写出一条即可)。
(2)浓盐酸与KMnO4反应的化学方程式为______。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是_____。反应结束后,“等待一段时间”再进行后续操作的原因是______。
(3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系:___。
(4)H管中铜丝不直接放置在右管底部的优点是___(写出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类冶炼最多的金属元素是_______;请写出它与水在一定条件反应的化学方程式________熔点最低的金属是_________;导电性最好的金属是_________;人体内最多的金属元素是_________;海水中含量最多的金属元素是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的6 g CoCl26H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是______。
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是______。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是______。
(4)补全Ⅲ中的操作:______。
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L1 K2CrO4溶液作为指示剂,用c mol·L1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×106 mol·L1,Ag2CrO4(砖红色)6.5×105 mol·L1
①ⅱ中,滴定至终点的现象是______。
②制备的晶体中Cl-的质量分数是______(列计算式,Cl的相对原子质量:35.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁俗称为磁性氧化铁,通常用作颜料、抛光剂和电讯器材等。某化学兴趣小组取磁性氧化铁进行铝热反应实验并对产物进行探究。
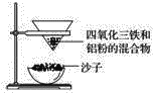
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是__________。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,则______(填“能”或“不能”)说明“铁块”一定不含四氧化三铁,理由是_________。
(3)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝,该实验所用的试剂是__________,反应的离子方程式为___________。
(4)请写出此铝热反应的化学方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com