
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 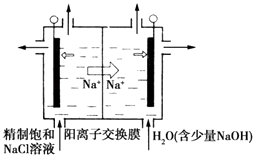
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.
【答案】
(1)Cl﹣﹣5e﹣+2H2O=ClO2↑+4H+;0.01
(2)O2+4e﹣=2O2﹣
(3)0.1
【解析】解:(1)①阳极发生氧化反应,由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,结合电荷守恒可知,同时生成氢离子,阳极电极反应式为:Cl﹣﹣5e﹣+2H2O=ClO2↑+4H+,
所以答案是:Cl﹣﹣5e﹣+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e﹣=H2↑,氢气的物质的量为 ![]() =0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,所以答案是:0.01;(2)燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是掺入了 Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子,根据原电池原理,正极O2得到电子生成负极O2﹣:O2+4e﹣=2O2﹣,所以答案是:O2+4e﹣=2O2﹣;(3)电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),100ml溶液中含有c(Cu2+)=1mol/L,c(H+)=4mol/L,c(Cl﹣)=4mol/L,c(SO42﹣)=1mol/L;
=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,所以答案是:0.01;(2)燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是掺入了 Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子,根据原电池原理,正极O2得到电子生成负极O2﹣:O2+4e﹣=2O2﹣,所以答案是:O2+4e﹣=2O2﹣;(3)电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),100ml溶液中含有c(Cu2+)=1mol/L,c(H+)=4mol/L,c(Cl﹣)=4mol/L,c(SO42﹣)=1mol/L;
阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x
阳极电极反应为:
2Cl﹣﹣ | 2e﹣= | Cl2↑,4OH﹣﹣ | 4e﹣=2H2O+ | O2↑ |
0.4mol | 0.4mol | 0.2mol | 4x | x |
阴极电极反应为:
Cu2++ | 2e﹣= | Cu, |
0.1mol | 0.2mol | 0.1mol |
2H++ | 2e﹣= | H2↑; | 2H++ | 2e﹣= | H2↑ |
0.4mol | 0.4mol | 0.2mol | 2x | x |
依据电子守恒0.4+4x=0.2+0.4+2x
x=0.1mol
阳极上收集到氧气的物质的量0.1mol;
所以答案是:0.1.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
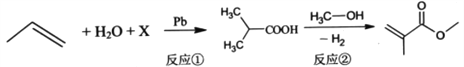 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Na、S是常见的六种元素。请回答下列问题。
(1)S在元素周期表中的位置为______________。
(2)上述元素中非金属性最强的是______________(填元素符号)。
(3)下列事实能说明O的非金属性比S的非金属性强的是________(填字母代号)。
a.O2与H2S溶液反应,溶液变浑浊
b.加热条件下H2S比H2O更容易分解
c.在氧化还原反应中,1 mol O2比1 mol S得电子多
d.H2O的沸点比H2S高
(4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为_________________。
(5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
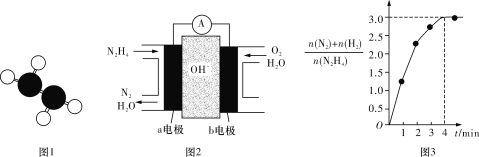
①已知肼的球棍模型如图1所示,试写出肼的电子式:______________。
②目前正在研发的一种肼燃料电池的结构如图2所示,________(填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l) ![]() N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,体积均为50mL物质的量浓度均为0.10mol/L的HX、HY、HZ三种弱酸,分别用0.10mol/L的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是

A. 浓度均为0.10mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50mLNaOH溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2 , 测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( ) 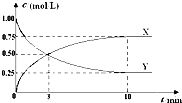
A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化
B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
C.平衡时H2 的转化率为75%
D.500℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)2SO2(g)+O2(g)2SO3(g)反应过程的能虽变化如图所示.己知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJ/mol. 
请回答下列问题:
①E的大小对该反应的反应热(填“有”或“无”)影构.
②图中△H=kJ/mol.
(2)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得) ①写出该反应的热化学方程式: .
②若lmol水蒸气转化为液态水放热45kJ,则反应H2(g)+ ![]() O2(g)=H2O(l)的△H=kJ/mol.
O2(g)=H2O(l)的△H=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com