
| m |
| M |
| n |
| V |
| ||
| 10.6g |
| 106g/mol |
| 0.1mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、SiO2、P2O5均能溶解在NaOH溶液中反应生成盐和水 |
| B、CuS,CaC2,Na2O2均能与稀硫酸反应产生气体 |
| C、F,Cl,Br,I的单质和氢化物的沸点随原子序数的增大而升高 |
| D、Li,Na,Mg,Al的最高价氧化物对应水化物的碱性逐渐减低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +W |
| +W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30 | B、42 | C、45 | D、60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
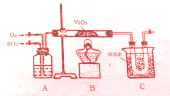 某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl- | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I- |
| B | 向澄清石灰水中通入少量CO2 气体 Ca2++2OH-+CO2=CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH-+SO2=CaSO3↓+H2O |
| C | 向Na2CO3溶液中滴入稀HNO3 CO32-+2H+=CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3 SO32-+2H+=SO2↑+H2O |
| D | CO2通入漂白粉溶液中 CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO | SO2通入漂白粉溶液中 SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
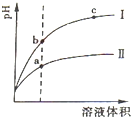 常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH
常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com