

| A. | P3=P4,y轴表示C的体积分数 | |
| B. | P3<P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
分析 根据图I知,相同温度下,根据先拐先平数值大知,P2>P1,知道压强C的含量升高,说明平衡正向移动,则x<2,为1;
相同压强下,根据先拐先平数值大知,T1>T2,升高温度,C含量降低,平衡逆向移动,则正反应是放热反应,△H<0,则该反应为A(g)+B(g)?C(g)△H<0;
A.P3=P4且温度相同时,C的体积分数应该相等;
B.相同温度时,P3<P4,增大压强,平衡向正反应方向移动,B的质量分数降低,升高温度平衡逆向移动;
C.相同温度时,P3<P4,增大压强,平衡向正反应方向移动,根据PV=nRT=PV=$\frac{m}{M}$RT得ρ=$\frac{PM}{RT}$,相同温度时,压强越大、摩尔质量越大其密度越大;
D.相同温度时,P3>P4,增大压强,平衡向正反应方向移动,气体的质量不变但物质的量减小,平均摩尔质量增大.
解答 解:根据图I知,相同温度下,根据先拐先平数值大知,P2>P1,知道压强C的含量升高,说明平衡正向移动,则x<2,为1;
相同压强下,根据先拐先平数值大知,T1>T2,升高温度,C含量降低,平衡逆向移动,则正反应是放热反应,△H<0,则该反应为A(g)+B(g)?C(g)△H<0;
A.P3=P4且温度相同时,C的体积分数应该相等,二者应该为同一曲线,故A错误;
B.相同温度时,P3<P4,增大压强,平衡向正反应方向移动,B的质量分数降低;该反应的正反应是放热反应,升高温度平衡逆向移动,则B质量分数增大,故B错误;
C.相同温度时,P3<P4,增大压强,平衡向正反应方向移动,气体的质量不变但物质的量减小,平均摩尔质量增大,根据PV=nRT=PV=$\frac{m}{M}$RT得ρ=$\frac{PM}{RT}$,相同温度时,压强越大、摩尔质量越大其密度越大,所以两条曲线应该互换位置,故C错误;
D.相同温度时,P3>P4,增大压强,平衡向正反应方向移动,气体的质量不变但物质的量减小,平均摩尔质量增大,故D正确;
故选D.
点评 本题考查图象分析,明确图象中纵横坐标含义及外界对化学平衡移动影响是解本题关键,易错选项是C,注意密度与压强、摩尔质量、温度的关系,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
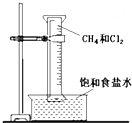 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag是还原剂 | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | Ag2S既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
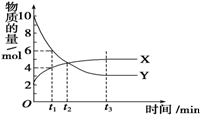 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的1.5倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③ | B. | 电负性:③>② | ||
| C. | 晶格能:NaCl>NaF | D. | 最高正化合价:③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com