
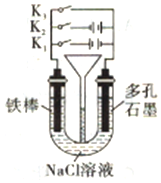
| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
分析 A.铁腐蚀的速度由大到小的顺序是:作电解池阳极>原电池负极>不形成电池>电解池阴极;
B.只闭合K3,是原电池反应,铁做负极,发生的是吸氧腐蚀,正极氧气得电子发生还原反应;
C.先只闭合K1,阳极上铁放电,阴极上氢离子放电,再只闭合K2,阳极上氯离子放电,阴极上氢离子放电,根据气体压强的变化判断反应现象;
D.只闭合K2,阳极上氯离子放电,阴极上氢离子放电,都生成气体,根据气体压强的变化判断液面变化;
解答 解:A.只接通K1时,该装置是电解池,铁作阳极,腐蚀最快,只闭合K3时,该装置构成原电池,铁作负极发生吸氧腐蚀,腐蚀较快,只闭合K2时,该装置构成电解池,铁作阴极而被保护,所以铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2,故A错误;
B.只闭合K3,是原电池反应,铁做负极,发生的是吸氧腐蚀,正极氧气得电子发生还原反应,电极反应式:2H2O+O2+4e-=4OH-,故B正确;
C.只闭合K1,阴极上氢离子放电生成氢气导致U型管右端液面下降,则漏斗内液面上升,再只闭合K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,漏斗内液面上升,故C正确;
D.只闭合K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,故D正确;
故选A.
点评 本题考查了原电池和电解池原理,难度较大,注意:如果电解池的阳极材料是活泼电极,则电解池工作时,阳极材料放电而不是电解质溶液中的阴离子放电,为易错点.


科目:高中化学 来源: 题型:选择题
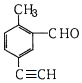
| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 与新制氢氧化铜悬浊液加热煮沸产生砖红色沉淀 | |
| C. | 1mol该物质和H2反应,最多消耗5molH2 | |
| D. | 苯环上的一氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃的酒精灯不小心打碎了,可直接用自来水灭火 | |
| B. | 点燃氢气前先验纯 | |
| C. | 蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 | |
| D. | 在实验室可以用口尝来鉴别化学药品 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
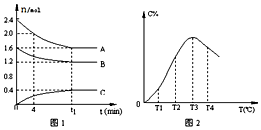
| A. | t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变 | |
| B. | 该反应的平衡常数表达式K=$\frac{c(C)}{{c}^{2}(A)•c(B)}$ | |
| C. | 由T1向T2变化时,V正>V逆 | |
| D. | 此反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
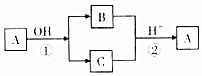 A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )| A. | A可能是金属,也可能是非金属 | B. | A、B、C含有一种相同的元素 | ||
| C. | B、C的水溶液一定都呈碱性 | D. | 反应①②不一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1L 0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA | |
| B. | 常温常压下,1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 100g KHCO3和CaCO3的混合物,含有的阳离子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com