
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
分析 A.电子、电荷不守恒;
B.反应生成KCl和碘;
C.反应生成硫酸亚铁和氢气;
D.电子、电荷不守恒,反应生成氯化铁.
解答 解:A.一小块钾投入冷水中的离子反应为2K+2H2O═2K++2OH-+H2↑,故A错误;
B.氯气通入碘化钠溶液中的离子反应为2I-+Cl2═I2+2Cl-,故B正确;
C.稀硫酸滴在铁片上的离子反应为Fe+2H+═Fe2++H2↑,故C错误;
D.氯气通入氯化亚铁溶液中的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,注意电子、电荷守恒的分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
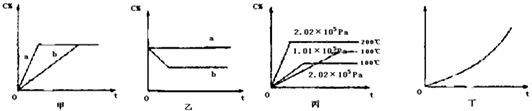
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的电子式: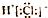 | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++$S{{O}_{4}}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2O;
+2H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
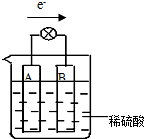 原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>D>C | B. | 非金属性:C>A | ||
| C. | 金属性:D>B | D. | 原子半径:B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0表示放热反应,△H>0表示吸热反应 | |
| B. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 | |
| C. | 在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com